题目内容
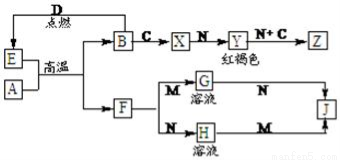
常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下。F、J既能溶于强酸M又能溶于强碱N,Z的摩尔质量为198 g·mol-1,且其中各元素的质量比为:钾:金属B:氧=39:28:32。
请回答下列问题:
(1)C的化学式为 ,Z的化学式为 。
(2)写出检验X中阳离子的方法 。
(3)写出E和A在高温下反应的化学方程式为 。
(4)写出A和N反应的离子方程式 。
(1)Cl2 (2分), K2FeO4(2分)
取试样少许,滴加3~4滴KSCN溶液,呈血红色(2分)
8 Al+3Fe3O4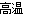 4Al2O3+9Fe (2分)
4Al2O3+9Fe (2分)
2Al+2OH—+2H2O=2AlO2-+3H2↑(2分)
【解析】
试题分析:A和B是金属单质,且二者在高温下发生置换反应,则该反应为铝热反应,所以A是Al,E是金属氧化物,F既能溶于强酸M又能溶于强碱N,F是Al2O3,B是常见金属,系列转化生成红褐色沉淀Y为Fe(OH)3,所以B是Fe,E是金属氧化物,所以D是O2,E是Fe3O4,铁和非金属单质反应生成X,X能和强碱N反应生成红褐色沉淀Fe(OH)3,氢氧化铁和碱、C反应生成Z,所以Z中含有铁元素,Z的摩尔质量为198g?mol-1,且其中各元素的质量比为:钾:铁:氧=39:28:32,钾、铁、氧的物质的量之比=39 39 :28 56 :32 16 =2:1:4,所以其化学式为K2FeO4,根据元素守恒知,强碱N为KOH,氢氧化铁能被C单质氧化,且C是气体,B和C反应生成铁盐,则C是Cl2,X是FeCl3,H为KAlO2,H和M反应生成J,J能溶于强酸和强碱,则J为Al(OH)3,
(1)通过以上分析知,C是氯气,Z是高铁酸钾,其化学式分别为:Cl2、K2FeO4,
(2)X是氯化铁,铁离子和硫氰根离子反应生成血红色溶液,所以可以用硫氰化钾溶液检验铁离子,其操作方法是:取试样少许,滴加3~4滴KSCN溶液,呈血红色,
(3)高温下,四氧化三铁和铝发生置换反应生成氧化铝和铁,反应方程式为:8 Al+3Fe3O4  4Al2O3+9Fe,
4Al2O3+9Fe,
(4)A是铝,N是氢氧化钾,铝和氢氧化钾溶液反应生成偏铝酸钾和氢气,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
考点:铝、铁及其化合物之间的转化