题目内容
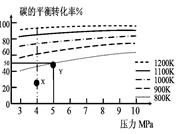
煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g) CH4(g)。在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示。下列说法正确的是
CH4(g)。在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示。下列说法正确的是
为前者碳的转化率高
 CH4(g)。在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示。下列说法正确的是
CH4(g)。在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示。下列说法正确的是
| A.上述正反应为吸热反应 |
| B.在4MPa、1200K时,图中X点υ(H2)正 >υ(H2)逆 |
C.在5MPa、800K时,该反应的平衡常数为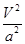 L2·mol-2 L2·mol-2 |
| D.工业上维持6MPa 1000K而不采用10MPa1000K,主要是因 |
AB
试题分析:A、由图观察,温度越高碳的平衡转化率越大,平衡正向移动,正反应为吸热反应,正确;B、X点是未平衡时,反应正向进行,正反应速率大于逆反应速率,正确;
C、此时碳转化率为50%
C(s)+2H2(g)
 CH4(g)
CH4(g)始量 a 2a
转化量0.5a a 0.5a
平衡量0.5a a 0.5a
k="(0.5a/V)/" ( a/V)2=0.5V/a,错误;
D、该选择的原因是两者转化率相差不大,但压强增大对设备要求高,能量需求大,错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2。下列说法正确的是
Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2。下列说法正确的是 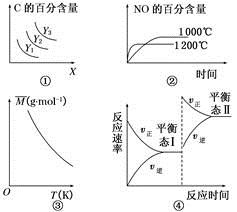
 3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1
3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响 2SO3是制造硫酸的重要反应。下列关于该反应的说法正确的是
2SO3是制造硫酸的重要反应。下列关于该反应的说法正确的是 2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是
2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是 xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol·L-1·min-1,下列说法正确的是
xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol·L-1·min-1,下列说法正确的是 pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m mol A 同时消耗q mol D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化。其中一定能说明反应已达到平衡状态的是( )
pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m mol A 同时消耗q mol D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化。其中一定能说明反应已达到平衡状态的是( ) xC(g) △H<0,测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
xC(g) △H<0,测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是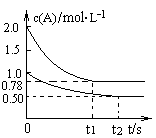
 W(?)+4Q(g) ΔH<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
W(?)+4Q(g) ΔH<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是