题目内容
【题目】利用氯碱工业的盐泥生产MgSO4·7H2O的工艺流程如下。[盐泥含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]:
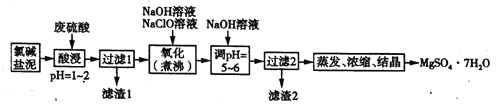
(1)酸浸时,FeCO3与硫酸反应的化学方程式为____________;滤渣1的主要成分为CaSO4和________(填化学式);为了提高浸取率可采取的措施有___________(填序号)。
a.多次用废硫酸浸取 b.减小盐泥粒度并充分搅拌 c.延长浸取时间
(2)氧化时,次氯酸钠溶液(碱性条件)将MnSO4氧化为MnO2的离子方程式为________;滤渣2为MnO2和_____________、________(填化学式)。
(3)镁的碳化物常见的有MgC2和Mg2C3 两种,分别可发生水解反应生成乙炔和丙二烯,MgC2的电子式为___________;丙二烯的结构简式为___________。
(4)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明可作防火材料的原理:_______________。
【答案】(1)FeCO3+H2SO4=FeSO4+CO2+H2O(2分);SiO2(2分);abc(2分);
(2)Mn2++2OH-+ClO-=MnO2↓+Cl-+H2O(2分);Fe(OH)3(1分);Al(OH)3(1分);
(3)![]() CH2=C=CH2(1分)
CH2=C=CH2(1分)
(4)4MgCO3·Mg(OH)2·5H2O![]() 5MgO+4CO2↑+6H2O
5MgO+4CO2↑+6H2O
【解析】
试题分析:含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2的固体混合物溶解于稀硫酸,得到MgSO4、MnSO4、Al2(SO4)3、FeSO4的混合液和不溶的SiO2和CaSO4,过滤得滤渣为SiO2和CaSO4;滤液中加入NaClO和NaOH溶液,可将Mn2+氧化为MnO2,通过过滤除去溶液中的Mn2+,同时溶液中的Fe2+氧化为Fe3+,通过调节溶液的pH=5~6,可使Al3+和Fe3+完全水解生成Fe(OH)3和Al(OH)3,过滤除去,滤渣2为MnO2、Fe(OH)3和Al(OH)3的混合物;最后将含MgSO4的溶液经过蒸发、浓缩、结晶得到MgSO4·7H2O,据此解析解题。
(1)酸浸时,FeCO3与硫酸反应的化学方程式为FeCO3+H2SO4=FeSO4+CO2+H2O;滤渣1的主要成分为CaSO4和SiO2;可能通过反复多次用废硫酸浸取、减小盐泥粒度并充分搅拌或延长浸取时间来提高浸取率,故答案为abc;
(2)在碱性条件下次氯酸钠将MnSO4氧化为MnO2的离子方程式为Mn2++2OH-+ClO-=MnO2↓+Cl-+H2O;滤渣2为MnO2和Fe(OH)3、Al(OH)3;
(3)MgC2中碳与碳之间存在三个电子对,其电子式为![]() ;丙二烯中含有两个碳碳双键,其结构简式为CH2=C=CH2;
;丙二烯中含有两个碳碳双键,其结构简式为CH2=C=CH2;
(4)碱式碳酸镁可用作防火保温材料,是因其在高温下能发生分解反应,生成MgO和CO2,化学方程式为4MgCO3·Mg(OH)2·5H2O![]() 5MgO+4CO2↑+6H2O。
5MgO+4CO2↑+6H2O。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案