题目内容
A、B、C、D四种元素处于同一短周期,在同族元素中,A的气态氢化物的沸点最高,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,C的电负性介于A、B之间,D与B相邻.
(1)C的原子的价电子排布式为
(2)在B的单质分子中存在
(3)已知B的气态氢化物很容易与H+结合,B原子与H+间形成的键叫
(4)在A、B、C、D四种元素形成的电子数相同的四种氢化物中沸点最低的是
(1)C的原子的价电子排布式为
2s22p4
2s22p4
.(2)在B的单质分子中存在
2
2
个π键,1
1
个σ键.(3)已知B的气态氢化物很容易与H+结合,B原子与H+间形成的键叫
配位键
配位键
,形成的离子立体构型为正四面体形
正四面体形
,其中B原子采取的杂化方式是sp3杂化
sp3杂化
.(4)在A、B、C、D四种元素形成的电子数相同的四种氢化物中沸点最低的是
CH4
CH4
(写分子式),其沸点显著低于其他三种氢化物的原因是:CH4分子间只有范德华力,而NH3、H2O、HF分子间除范德华力外还存在氢键
CH4分子间只有范德华力,而NH3、H2O、HF分子间除范德华力外还存在氢键
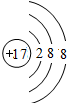
.分析:A的气态氢化物的相对分子质量在同族元素氢化物中不是最大的,而沸点最高,说明A的氢化物可形成氢键,故A可能是N、O、F中的一种,则A、B、C、D为第2周期元素,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,则B为N元素,C的电负性介于A、B之间,则C为O元素,A为F元素,D与B相邻则为C元素.
解答:解:A的气态氢化物的相对分子质量在同族元素氢化物中不是最大的,而沸点最高,说明A的氢化物可形成氢键,故A可能是N、O、F中的一种,则A、B、C、D为第2周期元素,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,则B为N元素,C的电负性介于A、B之间,则C为O元素,A为F元素,D与B相邻则为C元素.
(1)主族元素的价电子指最外层电子,C是O元素,O元素的最外层电子数是6,所以O原子的价电子排布式为2s22p4,故答案为:2s22p4;
(2)B的单质即N2,其结构式为N≡N,叁键中有2个π键,1个σ键,故答案为:2;1;
(3)B的气态氢化物是NH3,NH3分子中N原子上有一个孤对电子,可与H+以配位键结合成NH4+,据价电子对互斥理论,该微粒为正四面体形,其中N的杂化方式为sp3杂化,
故答案为:正四面体形;sp3;
(4)F的氢化物只有一种HF,电子数为10,其他有10个电子的氢化物分别是NH3、H2O、CH4,其中CH4沸点最低,因为只有CH4分子间、不能形成氢键,其他三种分子间均形成氢键,氢键的存在导致它们的沸点升高,所以它们的氢化物沸点显著高于CH4,
故答案为:CH4;CH4分子间只有范德华力,而NH3、H2O、HF分子间除范德华力外还存在氢键.
(1)主族元素的价电子指最外层电子,C是O元素,O元素的最外层电子数是6,所以O原子的价电子排布式为2s22p4,故答案为:2s22p4;
(2)B的单质即N2,其结构式为N≡N,叁键中有2个π键,1个σ键,故答案为:2;1;
(3)B的气态氢化物是NH3,NH3分子中N原子上有一个孤对电子,可与H+以配位键结合成NH4+,据价电子对互斥理论,该微粒为正四面体形,其中N的杂化方式为sp3杂化,
故答案为:正四面体形;sp3;
(4)F的氢化物只有一种HF,电子数为10,其他有10个电子的氢化物分别是NH3、H2O、CH4,其中CH4沸点最低,因为只有CH4分子间、不能形成氢键,其他三种分子间均形成氢键,氢键的存在导致它们的沸点升高,所以它们的氢化物沸点显著高于CH4,
故答案为:CH4;CH4分子间只有范德华力,而NH3、H2O、HF分子间除范德华力外还存在氢键.
点评:本题考查了元素位置、结构和性质的关系应用,根据物质的性质及元素周期律来推断元素,再结合物质的结构来分析解答,注意氢键只影响物理性质,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
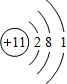
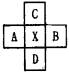
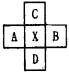
 ,B、C可形成离子化合物
,B、C可形成离子化合物 ,B、C可形成离子化合物
,B、C可形成离子化合物