题目内容
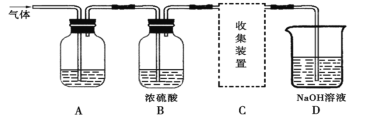
【题目】学生研究性学习小组设计实验,用于制取SO2并探究SO2的某些性质。制取SO2反应的化学方程式为:Na2SO3+2H2SO4→Na2SO4+SO2↑+H2O,产生的气体通入如图所示装置:
(实验探究)
(1)将12.6g的Na2SO3与足量的浓硫酸反应可制得SO2的体积为___________L(标准状况),该制取SO2的反应________(选填“是”或“不是”)氧化还原反应。
(2)若用A装置检验SO2具有漂白性,则A中的溶液是_________。
若用A装置检验SO2是一种酸性氧化物,则A中的溶液是_________。
(3)D装置中发生的反应是(写化学方程式):____________________________________。
(实验讨论)
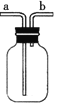
(4)对如图中的C处,甲、乙两同学都选用如图装置,但对连接方式持有不同意见。甲同学认为:SO2气体应从a处通入集气瓶中。乙同学认为:SO2气体应从b处通入集气瓶中。你认为________(填“甲”或“乙”)同学的看法是正确的。
(联系实际)
(5)SO2对环境的影响较大,为了减少SO2对空气的污染,请你从工业生产的角度提出一种有效可行的措施(用文字表述):________________________________________。
【答案】2.24 不是 品红溶液 石蕊试液 SO2+2NaOH=Na2SO3+H2O 甲 优先使用低硫燃料,对煤和石油进行脱硫;对燃烧后形成的烟气在排放之前除去硫的氧化物;开发其他清洁能源
【解析】
(1)由质量求出的Na2SO3物质的量,二氧化硫的物质的量与Na2SO3物质的量相等,带入n=![]() 求算体积,反应前后化合价发生变化的反应属于氧化还原反应;
求算体积,反应前后化合价发生变化的反应属于氧化还原反应;
(2)二氧化硫可使品红溶液褪色,表现了二氧化硫的漂白性;二氧化硫使石蕊试液变红,说明其溶于水显酸性;
(3)浓硫酸的作用是干燥二氧化硫气体,浓硫酸不能氧化二氧化硫气体;
(4)二氧化硫气体污染大气,为酸性气体,装置D氢氧化钠可吸收二氧化硫;二氧化硫气体密度比空气的大,应用向上排空气法收集;
(5)减少SO2对空气的污染可从产生源头、产生后吸收等方面采取措施.
(1)n(Na2SO3)= ![]() = 0.1 mol,根据化学方程式可知,二氧化硫的物质的量与Na2SO3物质的量相等,生成标准状况下的二氧化硫的体积V=0.1 mol×22.4 L/mol = 2.24 L;在Na2SO3+2H2SO4=Na2SO4+SO2↑+H2O中S的化合价没有发生变化,因此该反应不属于氧化还原反应,
= 0.1 mol,根据化学方程式可知,二氧化硫的物质的量与Na2SO3物质的量相等,生成标准状况下的二氧化硫的体积V=0.1 mol×22.4 L/mol = 2.24 L;在Na2SO3+2H2SO4=Na2SO4+SO2↑+H2O中S的化合价没有发生变化,因此该反应不属于氧化还原反应,
故答案为:2.24;不是;
(2)二氧化硫可使品红溶液褪色,表现了二氧化硫的漂白性,二氧化硫通入石蕊试液使其变红,说明二氧化硫是酸性氧化物,
故答案为:品红溶液褪色;石蕊试液;
(3)二氧化硫气体污染大气,二氧化硫能与氢氧化钠溶液反应而被吸收,因此装置D作为尾气吸收之用,其化学方程式为:SO2+2NaOH=Na2SO3+H2O,
故答案为:SO2+2NaOH=Na2SO3+H2O;
(4)二氧化硫气体密度比空气的大,应用向上排空气法收集,应该从a进入集气瓶,故甲同学正确,
故答案为:甲;
(5)从工业生产的角度来看,优先使用低硫燃料,对煤和石油进行脱硫;对燃烧后形成的烟气在排放之前除去硫的氧化物;开发其他清洁能源等都可以减少二氧化硫对环境的影响,故答案为优先使用低硫燃料,对煤和石油进行脱硫;对燃烧后形成的烟气在排放之前除去硫的氧化物;开发其他清洁能源。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案