题目内容
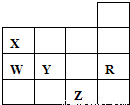
 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )分析:根据元素在周期表中的位置可知,X为N元素,W为P元素,Y为S元素,R为Ar元素,Z为Br元素,以此进行分析,
A、根据物质的在常压下的存在形式分析,常压下S、P为固体,而Br为液体;
B、Y的阴离子核外有18个电子,Z的阴离子核外有36个电子,以此进行分析;
C、同周期中,从左到右,元素的非金属性逐渐增强;
D、根据NH3含有氢键进行比较.
A、根据物质的在常压下的存在形式分析,常压下S、P为固体,而Br为液体;
B、Y的阴离子核外有18个电子,Z的阴离子核外有36个电子,以此进行分析;
C、同周期中,从左到右,元素的非金属性逐渐增强;
D、根据NH3含有氢键进行比较.
解答:解:根据元素在周期表中的位置可知,X为N元素,W为P元素,Y为S元素,R为Ar元素,Z为Br元素,
A、常压下S、P为固体,而Br为液体,所以五种元素的单质中Z单质的沸点不是最高的,故A错误;
B、Y的阴离子核外有18个电子,与R原子相同,Z的阴离子核外有36个电子,与R得电子层结构不相同,故B错误;
C、同周期中,从左到右,元素的非金属性逐渐增强,故C正确;
D、X为N元素,其氢化物为NH3,含有氢键,沸点较高,故D错误.
故选C.
A、常压下S、P为固体,而Br为液体,所以五种元素的单质中Z单质的沸点不是最高的,故A错误;
B、Y的阴离子核外有18个电子,与R原子相同,Z的阴离子核外有36个电子,与R得电子层结构不相同,故B错误;
C、同周期中,从左到右,元素的非金属性逐渐增强,故C正确;
D、X为N元素,其氢化物为NH3,含有氢键,沸点较高,故D错误.
故选C.
点评:本题考查元素周期表位构性的相互关系,题目难度不大,本题注意元素的性质的递变规律及其应用.

练习册系列答案
相关题目
 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) 如表为元素周期表前四周期的一部分,下列有关X、W、Y、R、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关X、W、Y、R、Z五种元素的叙述中,正确的是( )