题目内容
Ⅰ:CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
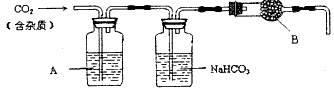
完成下列填空:
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6),应选用的仪器是______________。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是__________溶液,NaHCO3溶液可以吸收___________。
(3)上述装置中,B物质是___________,盛放B物质的仪器名称____________。
Ⅱ:实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4==ZnSO4+H2↑ MnO2+4HCl(浓)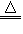 MnCl2+Cl2↑+2H2O 据此,从下列所给仪器装置中选择制备并收集H2的装置__________(填代号)和制备并收集干燥、纯净Cl2的装置___________(填代号)。可选用制备气体的装置
MnCl2+Cl2↑+2H2O 据此,从下列所给仪器装置中选择制备并收集H2的装置__________(填代号)和制备并收集干燥、纯净Cl2的装置___________(填代号)。可选用制备气体的装置
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6),应选用的仪器是______________。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是__________溶液,NaHCO3溶液可以吸收___________。
(3)上述装置中,B物质是___________,盛放B物质的仪器名称____________。
Ⅱ:实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4==ZnSO4+H2↑ MnO2+4HCl(浓)
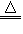 MnCl2+Cl2↑+2H2O 据此,从下列所给仪器装置中选择制备并收集H2的装置__________(填代号)和制备并收集干燥、纯净Cl2的装置___________(填代号)。可选用制备气体的装置
MnCl2+Cl2↑+2H2O 据此,从下列所给仪器装置中选择制备并收集H2的装置__________(填代号)和制备并收集干燥、纯净Cl2的装置___________(填代号)。可选用制备气体的装置
Ⅰ:
(1)a b c
(2)CuSO4溶液或酸性KMnO4溶液;吸收HCl气体或吸收酸性气体
(3)无水CaCl2;干燥管
Ⅱ:e;d
(1)a b c
(2)CuSO4溶液或酸性KMnO4溶液;吸收HCl气体或吸收酸性气体
(3)无水CaCl2;干燥管
Ⅱ:e;d

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 b
b  c
c 
 点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。
点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。

 b
b  c
c 

