题目内容
下列叙述不正确的是( )
分析:A.根据电荷守恒判断;
B.酸抑制水电离;
C.碳酸钠是强碱弱酸盐,升高温度促进碳酸根离子水解生成碳酸氢钠和氢氧化钠,加热时蒸发的是水,则平衡向左移动;
D.根据酸碱的相对强弱确定混合溶液的酸碱性.
B.酸抑制水电离;
C.碳酸钠是强碱弱酸盐,升高温度促进碳酸根离子水解生成碳酸氢钠和氢氧化钠,加热时蒸发的是水,则平衡向左移动;
D.根据酸碱的相对强弱确定混合溶液的酸碱性.
解答:解:A.任何溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(Cl-)+c(OH-),故A正确;
B.酸抑制水电离,所以在0.1mol/L的HNO3溶液中由水电离出的c(H+)<
,故B正确;
C.Na2CO3是多元弱酸盐,水溶液里分步水解:Na2CO3+H2O?NaHCO3+NaOH、NaHCO3+H2O?H2CO3+NaOH,水解以第一步为主,加热时,第一步水解产物NaHCO3和NaOH都不挥发,挥发的只是H2O,平衡向左移,最终得到Na2CO3,故C错误;
D.酸与碱完全中和,如果得到的是强碱弱酸盐,则所得溶液的pH大于7,故D正确;
故选C.
B.酸抑制水电离,所以在0.1mol/L的HNO3溶液中由水电离出的c(H+)<
| KW |
C.Na2CO3是多元弱酸盐,水溶液里分步水解:Na2CO3+H2O?NaHCO3+NaOH、NaHCO3+H2O?H2CO3+NaOH,水解以第一步为主,加热时,第一步水解产物NaHCO3和NaOH都不挥发,挥发的只是H2O,平衡向左移,最终得到Na2CO3,故C错误;
D.酸与碱完全中和,如果得到的是强碱弱酸盐,则所得溶液的pH大于7,故D正确;
故选C.
点评:本题考查了离子浓度大小的判断,根据酸或碱抑制水电离、盐类的水解、电荷守恒来分析解答,易错选项是B,很多同学任为“Na2CO3溶液发生水解:Na2CO3+H2O=H2CO3+NaOH,得到NaOH和H2CO3,其中H2CO3易发挥,加热挥发掉,则水解平衡向右移,则只剩NaOH,NaOH灼烧后得到Na2O”而导致错误,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
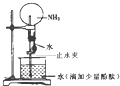 如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )
如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )| A、该实验说明氨气是一种极易溶于水的气体 | B、进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性 | C、氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化 | D、形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压 |
苯与乙烯相比较,下列叙述不正确的是( )
| A、都能燃烧,生成二氧化碳和水 | B、都容易发生加成反应 | C、乙烯易发生加成反应,苯只能在特殊条件下才发生加成反应 | D、乙烯易被酸性高锰酸钾溶液氧化,苯不能被酸性高锰酸钾溶液氧化 |