题目内容
【题目】海洋约占地球表面积的71%,具有巨大的开发潜力。
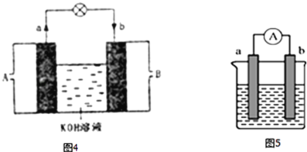
Ⅰ.海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等。下图所示为海水蒸馏原理示意图,请回答下列问题:
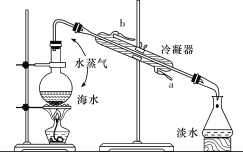
(1)冷却水的出水口是________(填“a”或“b”);
(2)碎瓷片的作用是__________。
Ⅱ.目前,从海水提取的溴占世界溴年产量的三分之一左右,空气吹出法是工业大规模海水提溴的常用方法。其中一种工艺流程为:
①海水浓缩,酸化;
②通入Cl2,使Br-转化为Br2;
③通入空气、水蒸气,将Br2吹入吸收塔,与吸收剂SO2反应转化为HBr;
④通入Cl2,再经过一系列处理得到产品Br2。
请回答下列问题:
(1)步骤②③的目的是_____________(填“富集溴”或“萃取溴”);
(2)在步骤③中,反应生成HBr的化学方程式___________________________________________;
(3)在步骤②中,若通入44.8 L Cl2(标准状况),理论上可得到Br2___________g。
【答案】b 防止暴沸 富集溴 SO2+Br2+2H2O=H2SO4+2HBr 320
【解析】
Ⅰ. (1)海水淡化时所用的冷凝管,进出水方向是“下进上出”;
(2) 在海水中加碎瓷片是为了防止暴沸;
Ⅱ. (1)根据②③步发生的反应可知,是为了将海水中的溴离子转化为溴单质吹出富集溴;
(2)第③步的反应是溴和水蒸气、二氧化硫发生了氧化还原反应生成了溴化氢和硫酸;
(3)根据溴离子与氯气发生反应的离子方程式计算通入44.8 L Cl2(标准状况),理论上可得Br2的质量。
(1)海水淡化过程中冷凝管的进出水方向是“下进上出”,所以b是出水口,
故答案为:b;
(2)在加热海水的过程中加入碎瓷片是为防止暴沸,
故答案为:防止暴沸;
(3)从海水中提取溴,是将溴离子转化为溴单质吹出,所以②③步操作的目的是富集溴,
故答案为:富集溴;
(4)溴、水蒸气、二氧化硫反应生成的是溴化氢和硫酸,化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr,
故答案为:SO2+Br2+2H2O=H2SO4+2HBr;
(5)第②步的反应是2Br-+Cl2=Br2+2Cl-,标准状况下44.8 L Cl2是2mol,可得到Br2是2mol,m(Br2)=n·M=2mol×160g/mol=320g,
故答案为:320。