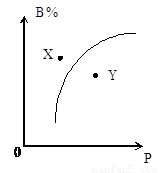题目内容
在室温下,下列叙述正确的是( )
A.将1 mL 1.0×10-5 mol/L盐酸稀释到1000 mL,得到pH=8 的盐酸
B.将1 mL pH=3的一元酸溶液稀释到10 mL,若溶液的pH<4,则此酸为弱酸
C.用pH=1的盐酸分别中和1 mL pH="13" NaOH溶液和氨水,NaOH消耗盐酸的体积大
D.pH=2的盐酸与pH=1的硫酸比较,2 c(Cl— )=c(SO42— )
【答案】
B
【解析】
试题分析:盐酸无论怎么稀释,其溶液的pH不可能大于7,A不正确;弱酸存在电离平衡,稀释促进电离,B正确;氨水是弱碱,在pH相等的条件下,氨水的浓度大于氢氧化钠溶液的浓度,C不正确,氨水消耗盐酸的体积大;D不正确,根据电荷守恒可知,c(OH-)+c(Cl—)=c(H+),c(OH-)+2c(SO42—)=c(H+)。所以根据pH=2的盐酸与pH=1的硫酸可,5 c(Cl— )=c(SO42— ),答案选B。
考点:考查pH的计算,弱电解质的稀释、中和滴定以及离子浓度大小比较
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的应试能力,提高学生的学习效率。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
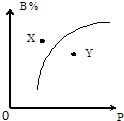 mA(s)+nB(g)?pC(g);△H<0,在室温条件下B的体积分数(B%)与压强(P)的关系如图所示,则下列有关叙述中一定正确的是( )
mA(s)+nB(g)?pC(g);△H<0,在室温条件下B的体积分数(B%)与压强(P)的关系如图所示,则下列有关叙述中一定正确的是( )①m+n<p
②X点时的正反应速率大于逆反应速率
③X点比Y点时的反应速率慢
④若升高温度,该反应的平衡常数增大.
| A、①②③ | B、②③④ | C、只有②③ | D、①②④ |
mA(s)+nB(g)  pC(g);ΔH<0,在室温条件下B的体积分数(B%)与压强(P)的关系如图所示。
pC(g);ΔH<0,在室温条件下B的体积分数(B%)与压强(P)的关系如图所示。
则下列有关叙述中一定正确的是( )
①m+n<p ②X点时的正反应速率大于逆反应速率
③X点比Y点时的反应速率慢 ④若升高温度,该反应的平衡常数增大
A.①②③ B.②③④ C.只有②③ D.①②④