题目内容
18.将8g SO3 加入到xg水中发生反应SO3+H2O═H2SO4,所形成的溶液中的H2SO4和水物质的量之比为1:5,则x的值为( )| A. | 90 | B. | 27 | C. | 10.8 | D. | 9 |
分析 根据n=$\frac{m}{M}$计算三氧化硫的物质的量,根据硫元素守恒计算H2SO4的物质的量,进而计算所得溶液中水的物质的量,根据m=nM计算H2SO4、溶液中溶剂水的质量,二者之和为溶液质量,根据质量守恒计算反应前水的质量.
解答 解:8g SO3 的物质的量为$\frac{8g}{80g/mol}$=0.1mol,根据硫元素守恒n(H2SO4)=n(SO3 )=0.1mol,则所得溶液中水的物质的量为0.1mol×5=0.5mol,故溶液质量=0.1mol×98g/mol+0.5mol×18g/mol=18.8g,根据质量守恒,可知反应前水的质量为18.8g-8g=10.8,故选C.
点评 本题考查化学方程式有关计算,比较基础,侧重对质量守恒定律的考查.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.溶质的质量分数为a%,溶质的物质的量浓度为c mol/L的硫酸溶液,蒸发溶剂,恢复到原来温度,若溶质的质量分数变为2a,则溶质的物质的量浓度变为( )
| A. | 大于2cmol/L | B. | 小于2cmol/L | ||
| C. | 等于2cmol/L | D. | 在cmol/L和2cmol/L之间 |
6.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 含0.1NA个CO32-的Na2CO3固体的质量为10.6g | |
| B. | 含1mol HCl的盐酸与足量Fe反应,Fe失去的电子总数为2NA | |
| C. | 水的摩尔质量就是NA个水分子的质量之和 | |
| D. | 2mol氦气含有电子数为8NA |
5.下列说法正确的是( )
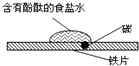

| A. | 氯化钠固体不导电,所以氯化钠是非电解质 | |
| B. | 向纯水中加入碳酸钠能使水的电离平衡正向移动,水的离子积增大 | |
| C. | 如右图研究的是铁的吸氧腐蚀,实验中红色首先在食盐水滴的中心出现 | |
| D. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 的△H<0△S<0 |
 A,B,C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如图所示关系.写出符合如图关系的A,B,C的化学式,(1)~(3)中的A不在同一主族.
A,B,C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如图所示关系.写出符合如图关系的A,B,C的化学式,(1)~(3)中的A不在同一主族.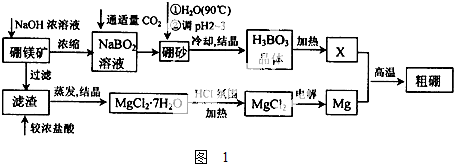
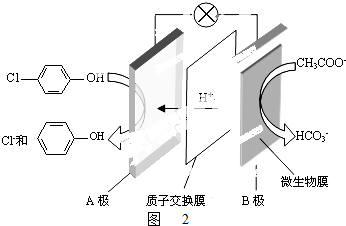
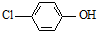 )的废水可以利用微生物电池除去,其原理如图2所示.
)的废水可以利用微生物电池除去,其原理如图2所示. +Cl-.
+Cl-.