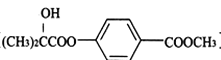
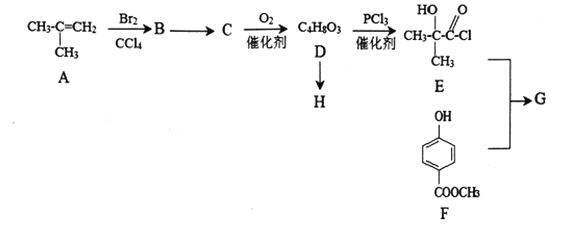
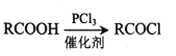
题目内容
【题目】某温度下,某容积恒定的密闭容器中发生如下可逆反应CO(g)+H2O(g)![]() H2(g)+CO2(g) △H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施可以采用的是
H2(g)+CO2(g) △H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施可以采用的是
A. 升高温度 B. 再加入2n mol H2
C. 再加入n mol CO和n mol H2O D. 再加入2n mol CO2和2n mol H2
【答案】D
【解析】达平衡时测得容器中各物质均为n mol,如果想使H2的平衡浓度增大一倍,就是使H2的物质的量变为2n mol(因为体积不变)。如果升高温度使H2的物质的量变为2n mol,就是要将该反应正向进行到底,但是可逆反应是不能完全进行的,选项A错误。加入2n mol的氢气,瞬间氢气为3n mol,如果变为2n mol氢气,就要逆向反应n mol氢气(同时必然反应n molCO2),这样CO2就被完全反应了,这是不成立的,选项B错误。可以计算出反应初始时加入的CO和H2O都是2n mol,再加入n mol CO和n mol H2O,相当于起始时加入的CO和H2O都是3n mol,这两个状态是等效平衡态,因为两种情况的初始投料量是2:3的,所以该平衡态是初始平衡态的1.5倍,即达平衡时氢气是原平衡的1.5倍,也就是1.5n mol,选项C错误。由上,再加入2n mol CO2和2n mol H2,相当于起始时加入的CO和H2O都是4n mol,这个状态与初始平衡依然是等效平衡态,因为两种情况的初始投料量是1:2的,所以该平衡态是初始平衡态的2倍,即达平衡时氢气是原平衡的2倍,也就是2n mol,选项D正确。

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目