题目内容
将一定量的Fe和Fe0的混合物投入250mL 2mol/L硝酸中,反应完全后生成1.12L NO(标况),再向反应后的溶液中加入1mol/L NaOH溶液,要使铁元素完全沉淀下来,所加入NaOH溶液的体积最少是
- A.450 mL
- B.500 mL
- C.400 mL
- D.不能确定
A
分析:当加入的氢氧化钠使铁元素完全沉淀恰好沉淀,所需的氢氧化钠溶液体积最小,此时溶液中溶质为硝酸钠,根据钠离子守恒有n(NaOH)=n(NaNO3),根据氮元素守恒有n(NaNO3)+n(NO)=n(HNO3),据此计算n(NaOH),在根据V=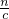 计算NaOH溶液的体积.
计算NaOH溶液的体积.
解答:当加入的氢氧化钠使铁元素完全沉淀恰好沉淀,所需的氢氧化钠溶液体积最小,此时溶液中溶质为硝酸钠,
根据氮元素守恒有n(NaNO3)+n(NO)=n(HNO3),故n(NaNO3)=0.25L×2mol/L-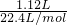 =0.45mol,
=0.45mol,
根据钠离子守恒有n(NaOH)=n(NaNO3)=0.45mol,
故需要NaOH溶液的最小体积为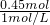 =0.45L=450mL,
=0.45L=450mL,
故选A.
点评:本题考查物质的量浓度的有关计算、混合物反应的计算,难度中等,关键清楚反应过程根据离子守恒进行计算.
分析:当加入的氢氧化钠使铁元素完全沉淀恰好沉淀,所需的氢氧化钠溶液体积最小,此时溶液中溶质为硝酸钠,根据钠离子守恒有n(NaOH)=n(NaNO3),根据氮元素守恒有n(NaNO3)+n(NO)=n(HNO3),据此计算n(NaOH),在根据V=
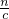 计算NaOH溶液的体积.
计算NaOH溶液的体积.解答:当加入的氢氧化钠使铁元素完全沉淀恰好沉淀,所需的氢氧化钠溶液体积最小,此时溶液中溶质为硝酸钠,
根据氮元素守恒有n(NaNO3)+n(NO)=n(HNO3),故n(NaNO3)=0.25L×2mol/L-
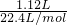 =0.45mol,
=0.45mol,根据钠离子守恒有n(NaOH)=n(NaNO3)=0.45mol,
故需要NaOH溶液的最小体积为
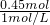 =0.45L=450mL,
=0.45L=450mL,故选A.
点评:本题考查物质的量浓度的有关计算、混合物反应的计算,难度中等,关键清楚反应过程根据离子守恒进行计算.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目