题目内容
【题目】氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。其制取原理为: Al2O3+3C+N2![]() 2 AlN+3CO
2 AlN+3CO
为了分析某AlN样品中 AlN的含量,某化学研究性学习小组成员设计了如下两种实验方案。
【方案1——量气法】用图中的一些装置来进行相关实验,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。

(1)图中仪器A的名称是 _______;写出AlN和NaOH溶液反应的化学方程式________。
(2)广口瓶中的试剂X最好选用下列试剂中的_______(填选项的标号),广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将________(填“偏大”、 “偏小”或“不变”)。
A.苯 B.酒精 C.植物油 D.CCl4
(3)若实验中测得样品的质量为2.56g,氨气的体积为1.12L(标况下),则样品中AlN的质量分数为______。
【方案2——测重量】按以下步骤测定样品中A1N的纯度:

(4)步骤②生成沉淀的离子方程式为_______________。
(5)步骤③的操作是_____________。
(6)A1N的纯度是______________(用m1、m2表示)。
【答案】 分液漏斗 AlN+NaOH+H2O=NaAlO2+NH3↑ C 不变 80.1% CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓ 过滤、洗涤 ![]()
【解析】(1)依据装置图分析可知A为分液漏斗,氮化铝与NaOH溶液反应生成偏铝酸钠和氨气,反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑;(2)A、苯易挥发,会浪费试剂,排出液体增大,影响氨气体积测定,A不选;B、酒精易挥发,挥发出来的气体对实验有影响,同时由于酒精与水任意比互溶,也不能达到隔离的目的,B不选;C、植物油既不溶于水,密度小于水也不易挥发,可以把氨气与水进行隔离,C选;D、CCl4密度大于水,不能起到隔离作用,D不选;答案选C;本次实验的目的在于测定产生气体的体积而不是收集纯净的气体,氨气排出装多少水,氨气的体积就是多少,广口瓶内的液体是否充满不影响所收集到的NH3体积大小;(3)由于AlN跟氢氧化钠溶液反应生成NaAlO2、并放出NH3,其反应方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,生成NH3的物质的量为1.12L÷22.4L/mol=0.05mol,根据氮元素守恒可知2.56g样品中含有AlN的物质的量为0.05mol,AlN的质量为0.05mol×41g/mol=2.05g,样品中AlN的质量分数为2.05g/2.56g×100%=80.1%;(4)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;(5)上述分析可知步骤③是过滤洗涤得到氢氧化铝沉淀;(6)测定原理是:A1N+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,氢氧化铝灼烧得到氧化铝,通过测定氧化铝得质量来计算氮化铝的质量,Al2O3物质的量= ![]() ,依据氮元素守恒得到样品中氮元素物质的量=n(AlN)=
,依据氮元素守恒得到样品中氮元素物质的量=n(AlN)= ![]() ,A1N的纯度=
,A1N的纯度=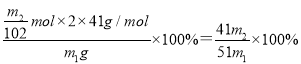 。
。
