题目内容
试样A是由氧化铁和氧化铜组成.取质量相等的两份试样按下图进行实验,最后得到不溶物F和溶液G,不溶物F加入盐酸能放出气体.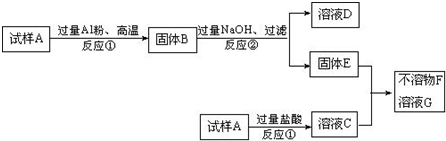
(1)写出反应①中氧化铁与铝粉反应的反应方程式:
(2)溶液G中的溶质是
(3)写出反应②有关的两个离子方程式:
(1)反应①中氧化铁与铝粉反应的反应方程式为:Fe2O3+2Al
| ||
故答案为:Fe2O3+2Al
| ||
(2)结合分析过程可知G为氯化亚铁,故答案为:FeCl2;
(3)反应②有关的两个离子方程式是铝和氢氧化钠溶液反应,反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑;氧化铝和氢氧化钠溶液反应,反应的离子方程式为:
Al2O3+2OH-=2AlO2-+H2O,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;Al2O3+2OH-=2AlO2-+H2O.

 名校课堂系列答案
名校课堂系列答案(10分) 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L—1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是 。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② |
|
[实验二]向实验一的锥形瓶里滴加1 mol·L—1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。
[实验三]请设计合理实验检验实验二所得溶液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、滴管、1 mol·L-1NaOH溶液、1 mol·L-1HCl溶液、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。(可填满、可不填满)
| 实验操作 | 预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
|
| …… |
|
[实验四]粉末状试样A是由MgO和Fe2O3组成的混合物。取适量A进行铝热反应,产物中有单质B生成。产物中的单质B是 (填化学式)。
(10分)某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L—1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是 。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② | |
[实验三]请设计合理实验检验实验二所得溶液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、滴管、1 mol·L-1NaOH溶液、1 mol·L-1HCl溶液、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。(可填满、可不填满)
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| …… | |
(10分) 某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L—1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是 。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
|
方法 |
需测定的数据 |
|
① |
测定产生的H2的体积 |
|
② |
|
[实验二]向实验一的锥形瓶里滴加1 mol·L—1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。
[实验三]请设计合理实验检验实验二所得溶液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、滴管、1 mol·L-1NaOH溶液、1 mol·L-1HCl溶液、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。(可填满、可不填满)
|
实验操作 |
预期现象和结论 |
|
步骤1: |
|
|
步骤2: |
|
|
…… |
|
[实验四]粉末状试样A是由MgO和Fe2O3组成的混合物。取适量A进行铝热反应,产物中有单质B生成。产物中的单质B是 (填化学式)。
某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
[实验一]从镁铝合金片上剪下一小块,先称重,然后投到盛有10mL 10mol·L—1NaOH溶液(足量)的锥形瓶里。
(1)从反应开始至反应结束,依次可观察到的现象有:①切口断面处先产生气泡,反应由慢到快;②小块合金在溶液中上下翻腾;③溶液升温;④反应后,溶液中残留黑色固体。
(2)开始时产生气泡速率慢,其主要原因(除温度、电化学因素外)是 。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①写出另一种不同方法所需数据。
| 方法 | 需测定的数据 |
| ① | 测定产生的H2的体积 |
| ② |
|
[实验二]向实验一的锥形瓶里滴加1 mol·L—1HCl,使镁、铝两种元素恰好只以氯化物的形式存在。
[实验三]请设计合理实验检验实验二所得溶液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、滴管、1 mol·L-1NaOH溶液、1 mol·L-1HCl溶液、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。(可填满、可不填满)
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| …… |
[实验四]粉末状试样A是由MgO和Fe2O3组成的混合物。取适量A进行铝热反应,产物中有单质B生成。产物中的单质B是 (填化学式)。