题目内容
(15分)
在常温下,某水溶液M中。
(1)若M中存在的离子只有:Na+、CH3COO-、H+、OH-,下列关系合理的是 。
① c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ② c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
③ c(H+)>c(OH-)>c(Na+)>c(CH3COO-) ④ c(Na+)=c(CH3COO-)且c(OH-)=c(H+)
(2)若M由两种相同物质的量浓度的溶液混合而成,其中只存在OH—、H+、NH4+、Cl-四种离子,且c(NH4+)>c(Cl-)>c(OH—)>c(H+),这两种溶液的溶质是 。
(3)若M为0.01 mol/L的氨水,向其中加入等体积pH=2的盐酸溶液(忽略溶液体积变化),所得混合液中:c(NH4+)+c(H+)-c(OH-)= 。
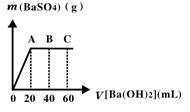
(4)若M为20 mL稀硫酸和盐酸混合液,向该混合酸溶液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60 mL Ba(OH)2溶液时,C点溶液的pH=7(忽略溶液体积变化),试计算:
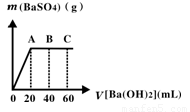
(i)最初混合酸溶液中c(H2SO4)=__________,c(HCl)=____________。
(ii)B点溶液的pH为多少?(写出计算过程。可能用到的数据:1g2=0.30、1g3=0.48)
(15分)
(1)①②④ (3分,见错不得分,对一个得1分,对二个得2分)
(2)NH4Cl和 NH3(或NH4Cl和 NH3·H2O) (2分)
(3)0.005 mol/L (2分,无单位不得分)
(4)(i)c(H2SO4) =0.05 mol/L (2分,无单位不得分)
c(HCl) =0.20 mol/L (2分,无单位不得分)
(ii)方法一:最初混合酸中:c(H+)=0.05 mol/L×2+0.20 mol/L=0.30 mol/L
B点时加入的碱中:c(OH-)=0.10 mol/L (1分)
反应后,B点过量剩余:c(H+)=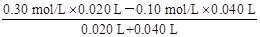
=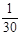 mol/L (2分)
mol/L (2分)
则pH=1.48 (1分)
方法二:由题意和图示可知:BC段中和的就是B点过量的H+(1分)
c(H+)=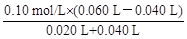 =
=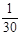 mol/L (2分)
mol/L (2分)
则pH=1.48 (1分)
【解析】

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案