题目内容
(12分)由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子。已知A、E是由非金属元素组成的阳离子,六种微粒间有下列关系:
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1 mol B离子与1 mol E离子作用可生成2 mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解。
(1) 微粒A的化学式是_____________;微粒E的名称是___________________。构成微粒F的元素在元素周期表中的位置是____________________________。
(2) 写出F与过量C溶液反应的离子方程式:___________________ ______
(3) 写出由C的水溶液制[Cu(NH3)4]SO4·H2O晶体的两个主要离子反应方程式:
(1) NH4+ 水合氢离子 第三周期、ⅢA族
(2)Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(3)Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
【解析】
试题分析:10个电子的粒子中NH4++OH-=NH3+H2O,A是阳离子,所以A是NH4+,B是OH-。C为气态,且可使湿润的红色石蕊试纸变蓝,C是NH3,D是H2O。1 mol B离子与1 mol E离子作用可生成2 mol D分子,E是H3O+。向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解,则F为Al3+,W为Al(OH)3。
制备[Cu(NH3)4]SO4·H2O晶体,应向CuSO4溶液中通入NH3,先产生蓝色沉淀,后沉淀溶解,变成深蓝色溶液,其发生的离子反应为Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-。
考点:元素推断
点评:10电子粒子推断题是各地市高考的一个热点,要熟练掌握10电子粒子都有哪些,还要了解其中发生的两个反应。

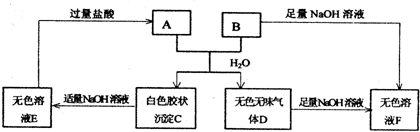

 A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)