题目内容
为测定某石灰石中CaCO3的质量分数,称取W g石灰石样品,加入过量的浓度为6 mol/L的盐酸,使它完全溶解,加热煮沸,除去溶解的CO2,再加入足量的草酸铵[(NH4)2C2O4]溶液后,慢慢加入氨水降低溶液的酸度,则析出草酸钙沉淀,离子方程式为:C2O2-4+Ca2+=CaC2O4↓,过滤出CaC2O4后,用稀硫酸溶解:CaC2O4+H2SO4=H2C2O4 +CaSO4,再用蒸馏水稀释溶液至V0 mL。取出V1 mL用a mol/L的KMnO4酸性溶液滴定,此时发生反应:
2MnO- 4+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
若滴定终点时消耗a mol/L的KMnO4 V2 mL,计算样品中CaCO3的质量分数。
2MnO- 4+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
若滴定终点时消耗a mol/L的KMnO4 V2 mL,计算样品中CaCO3的质量分数。
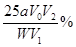
分析:本题涉及到化学方程式或离子方程式为:
CaCO3+2HCl=CaCl2+H2O+CO2↑ C2O2-4+Ca2+=CaC2O4↓
CaC2O4+H2SO4=H2C2O4+CaSO4 2MnO- 4+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
由方程式可以得出相应的关系式:
5CaCO3——5Ca2+——5CaC2O4——5H2C2O4——2MnO-4
5 2
n1(CaCO3) aV2×10-3 mol
n1(CaCO3) =" 2.5" aV2×10-3 mol
样品中:n(CaCO3) = 2.5 aV2×10-3×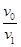 mol
mol
则:ω(CaCO3) =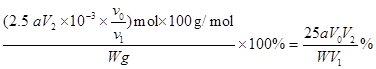
CaCO3+2HCl=CaCl2+H2O+CO2↑ C2O2-4+Ca2+=CaC2O4↓
CaC2O4+H2SO4=H2C2O4+CaSO4 2MnO- 4+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
由方程式可以得出相应的关系式:
5CaCO3——5Ca2+——5CaC2O4——5H2C2O4——2MnO-4
5 2
n1(CaCO3) aV2×10-3 mol
n1(CaCO3) =" 2.5" aV2×10-3 mol
样品中:n(CaCO3) = 2.5 aV2×10-3×
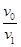 mol
mol 则:ω(CaCO3) =
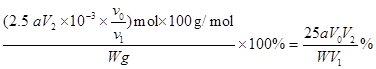

练习册系列答案
相关题目

 Si(s) + 3HCl(g), 不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如右图所示。下列说法正确的是________(填字母序号)。
Si(s) + 3HCl(g), 不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如右图所示。下列说法正确的是________(填字母序号)。

 + Cl-+ H2O
+ Cl-+ H2O