题目内容
正确掌握化学用语和化学基本概念是学好化学的基础.下列有关表述中正确的一项是( )
| A、Br的电子排布式可简写为[Ar]4s24p5 | B、16O与18O互为同位素,H216O、D216O、H218O、D218O互为同素异形体 | C、SiH4、CH4、NH4+粒子的空间构型为正四面体型;CO2、BeCl2均为直线型分子 | D、Ca2+的结构示意图为 ;NH4Cl的电子式为 ;NH4Cl的电子式为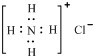 |
分析:A.溴是35号元素;
B.质子数相同中子数不同的原子互称同位素,同一种元素的不同单质互为同素异形体;
C.SiH4、CH4、NH4+中心原子为sp3杂化,CO2、BeCl2中心原子为sp杂化;
D.当核电荷数=质子数<核外电子数,为阴离子,氯离子电子式书写错误.无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷.
B.质子数相同中子数不同的原子互称同位素,同一种元素的不同单质互为同素异形体;
C.SiH4、CH4、NH4+中心原子为sp3杂化,CO2、BeCl2中心原子为sp杂化;
D.当核电荷数=质子数<核外电子数,为阴离子,氯离子电子式书写错误.无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷.
解答:解:A.根据核外电子排布规律可知Br的电子排布式可简写为[Ar]3d104s24p5,故A错误;
B.16O与18O质子数相同中子数不同互为同位素;同素异形体必须是单质,H216O、D216O、H218O、D218O不是同一元素的单质,不互为同素异形体,故B错误;
C.在常见的化合物中SiH4、CH4、NH4+中心原子为sp3杂化,为正四面体结构,CO2、BeCl2中碳、Be为sp杂化,为直线型分子,故C正确;
D.核电荷数=质子数=20<核外电子数=18,Ca2+的结构示意图为 ,氯化铵是离子化合物,由铵根离子与氯离子构成,其电子式为
,氯化铵是离子化合物,由铵根离子与氯离子构成,其电子式为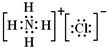 ,故D错误.
,故D错误.
故选:C.
B.16O与18O质子数相同中子数不同互为同位素;同素异形体必须是单质,H216O、D216O、H218O、D218O不是同一元素的单质,不互为同素异形体,故B错误;
C.在常见的化合物中SiH4、CH4、NH4+中心原子为sp3杂化,为正四面体结构,CO2、BeCl2中碳、Be为sp杂化,为直线型分子,故C正确;
D.核电荷数=质子数=20<核外电子数=18,Ca2+的结构示意图为
 ,氯化铵是离子化合物,由铵根离子与氯离子构成,其电子式为
,氯化铵是离子化合物,由铵根离子与氯离子构成,其电子式为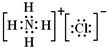 ,故D错误.
,故D错误.故选:C.
点评:本题考查电子排布式,同位素,同素异形体,原子结构示意图,电子式,空间构型等,注意当核电荷数=质子数<核外电子数,为阴离子.

练习册系列答案
相关题目
正确掌握化学用语和化学基本概念是学好化学的基础.下列有关表述中正确的一组是( )
| A、过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)所含官能团相同;两者互为同分异构体 | B、16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体 | C、SiH4、CH4、NH4+粒子的空间构型均为正四面体型;CO2、C2H2均为直线型分子 | D、Ca2+的结构示意图为 ,NH4Cl的电子式为 ,NH4Cl的电子式为 |
正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A.过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)互为同分异构体;
|
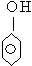 与
与
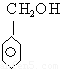 互为同系物
互为同系物
B.金刚石、CH4、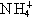 粒子的空间构型均为正四面体;晶体硅、碳化硅均为原子晶体
粒子的空间构型均为正四面体;晶体硅、碳化硅均为原子晶体
C.16O与18O互为同位素;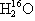 、
、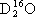 、
、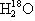 、
、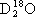 互为同素异形体
互为同素异形体
D.Ca2+的结构示意图为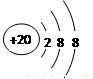 ,NH4CI的电子式为
,NH4CI的电子式为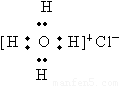
 粒子的空间构型为正四面体型;CO2、C2H2均为直线型分子
粒子的空间构型为正四面体型;CO2、C2H2均为直线型分子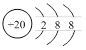 ;NH4Cl的电子式为
;NH4Cl的电子式为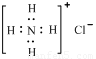
 (三个原子在同一直线上)
(三个原子在同一直线上)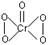 ,该氧化物中Cr为+6价
,该氧化物中Cr为+6价