��Ŀ����
����Ŀ���Ӻ�ˮ�п��Ի�õ�ˮ��ʳ�β�����ȡþ��������ʣ�
��1����ˮ�����ķ�����Ҫ������һ�֣���
��2���������ʲ���Ҫ������ѧ�仯���ܴӺ�ˮ�л�õ��������� ��������ţ���
A.Һ��
B.ʳ��
C.����
D.��ˮ
��3���Ӻ�ˮ����ȡ���þ���������£� 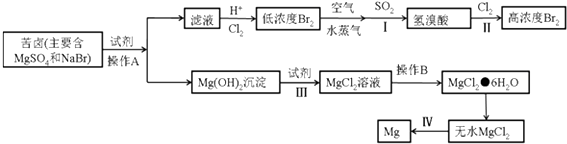
��д�����в�������ӷ���ʽ��ѧ����ʽ��
����I�Ļ�ѧ����ʽ�� ��
����III�����ӷ���ʽ�� ��
����IV�Ļ�ѧ����ʽ�� ��
�ڲ���A�� �� ����B�� �� �Ӳ���II�õ�����Һ����ȡ�廹��Ҫ���еIJ����У�����ȡ������
���𰸡�
��1������
��2��BD
��3��SO2+Br2+H2O�T�T2HBr+H2SO4�� Mg��OH��2+2H+=Mg2++2H2O�� MgCl2�����ڣ� ![]() Mg+Cl2�������ˣ���ȴ�ᾧ����Һ
Mg+Cl2�������ˣ���ȴ�ᾧ����Һ
���������⣺��1����ˮ�����ij��÷���Ϊ����ˮ���ᷨ�������������������ӽ�������
�ʴ�Ϊ����ˮ���ᷨ�������������������ӽ�������ѡ������һ��������2��A��ͨ����������Ȼ��Ƶõ��ƺ��������ǻ�ѧ�仯��ͨ������������������Ϊ�嵥�ʣ��ǻ�ѧ�仯����A����
B���Ѻ�ˮ��̫����ɹ������ˮ�ֺ�ʳ�Σ�����Ҫ��ѧ�仯���ܹ��Ӻ�ˮ�л�ã���B��ȷ��
ͨ����������Ȼ��Ƶõ��ƺ��������ǻ�ѧ�仯��ͨ��������ڵ��Ȼ�þ������������þ�������ǻ�ѧ�仯����B��ȷ��
C����ˮ����Ԫ��Ϊ����̬�����ˮ�������������ⱥ��ʳ��ˮ�������������˻�ѧ��Ӧ���ǻ�ѧ�仯����C����
D���Ѻ�ˮ������ȷ������Եõ���ˮ����ѧ�仯����D��ȷ��
�ʴ�Ϊ��BD����3���ٲ���I�Ƕ���������嵥�ʷ���������ԭ��Ӧ����������廯�⣬��Ӧ�Ļ�ѧ����ʽΪ��SO2+Br2+H2O�T�T2HBr+H2SO4 ��
�ʴ�Ϊ��SO2+Br2+H2O�T�T2HBr+H2SO4 ��
����III��������þ�ܽ������������Ȼ�þ��Һ����Ӧ�����ӷ���ʽΪ��Mg��OH��2+2H+=Mg2++2H2O��
�ʴ�Ϊ��Mg��OH��2+2H+=Mg2++2H2O��
����IV�ǵ�������Ȼ�þ�õ�����þ����������Ӧ�Ļ�ѧ����ʽΪ��MgCl2�����ڣ� ![]() Mg+Cl2����
Mg+Cl2����
�ʴ�Ϊ��MgCl2�����ڣ� ![]() Mg+Cl2����
Mg+Cl2����
�ڲ���A�Ƿ���������Һ�IJ���Ϊ���ˣ�����B����Һ�з���õ����ʹ���IJ�����ͨ��������Ũ������ȴ�ᾧ������ϴ�ӵõ��Ȼ�þ���壬�Ӳ���II�õ�����Һ����ȡ�廹��Ҫ���еIJ�������ȡ��Һ������õ�Һ�壬
�ʴ�Ϊ�����ˣ���ȴ�ᾧ����Һ��
��1�����ݺ�ˮ�����ij��÷�������ˮ���ᷨ�������������������ӽ���������2���Ӻ�ˮ�����ʵ�ԭ��ȥ������
A����ˮ����Ԫ��Ϊ���ӣ��仯Ϊ������Ҫ������ѧ��Ӧ��
B����ˮ��̫����ɹ������ˮ�ֺ�ʳ�Σ�
C����Ԫ�غ�ˮ�д����ǻ���̬���仯Ϊ������Ҫ������ѧ��Ӧ��
D����ˮ�����Ƿ��������ˮ���仯�����������������ɣ��������仯����3����±����Ҫ������þ���廯þ�������Լ��������Ƴ���þ���ӹ��˵õ�������þ�����������Լ���Ϊ���ᣬ������þ�ܽ�������õ��Ȼ�þ��Һ��ͨ������B����Ũ������ȴ�ᾧ������ϴ�ӵõ��Ȼ�þ���壬���Ȼ��������м���ʧȥ�ᾧˮ�õ������Ȼ�þ��������ǵ������Ȼ�þ�õ�����þ������������þ���Ӻ����Һ���ữͨ���������������������嵥�ʣ��õ���Ũ�ȵ��嵥����Һ���ÿ��������嵥�ʣ��ö����������շ���������ԭ��Ӧ�����廯�⣬��ͨ�����������廯��õ���Ũ�ȵ��嵥�ʣ�
�ٲ���I�Ƕ���������嵥�ʷ���������ԭ��Ӧ����������廯�⣻
����III��������þ�ܽ������������Ȼ�þ��Һ
����IV�ǵ�������Ȼ�þ�õ�����þ��������
�ڷ�����֪����A�Ƿ���������Һ�IJ���Ϊ���ˣ�����B����Һ�з���õ����ʹ���IJ�����ͨ��������Ũ������ȴ�ᾧ������ϴ�ӵõ��Ȼ�þ���壬�Ӳ���II�õ�����Һ����ȡ�廹��Ҫ���еIJ�������ȡ��Һ������õ�Һ�壻

����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵó���Ӧʵ����۵��ǣ� �� 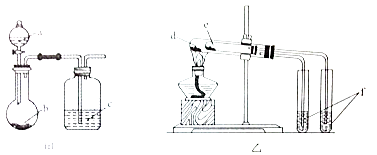
ѡ�� | ʵ���Լ� | ʵ����� | ||
A | a��ϡ���� | b��̼������ | c����������Һ | ���ԣ����̼����� |
B | a��ϡ���� | b���������� | c���廯����Һ | �����ԣ�MnO2��Cl2��Br2 |
C | d��С�մ� | e���մ� | f��ʯ��ˮ | ���ȶ��ԣ��մ�С�մ� |
D | d���Ȼ��� | e���Ȼ�� | f����������Һ | �е㣺�Ȼ��ƣ��Ȼ�� |
A.A
B.B
C.C
D.D

