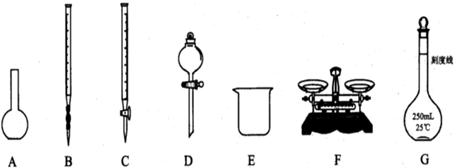
题目内容
然后,可采用下列两种方法进行测定:
| 方法一 | 方法二 |
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量BaCl2溶液,充分搅拌,使沉淀完全; ⑥过滤、洗涤、干燥沉淀、称量得到bg固体. |
④将25.00mL溶液置于锥形瓶中; ⑤用0.1mol/L的酸性KMnO4溶液进行滴定,达到滴定终点时,消耗10.00mL溶液. |

请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的仪器是E和
(2)在方法一④中加入过量稀盐酸的目的是
(3)在方法一测定得到Na2SO3样品的纯度是
| 1420b |
| 233a |
| 1420b |
| 233a |
(4)在方法二中,是否需要加入指示剂
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果
(2)方法一是加入盐酸是为了除去亚硫酸根离子排除亚硫酸根离子的干扰;
(3)在方法一测定得到Na2SO3样品的纯度是利用称量沉淀质量减小计算得到;
(4)方法二是利用高锰酸钾溶液滴定溶液氧化亚硫酸钠实现定量测定,滴定过程中高锰酸钾溶液是紫红色溶液,不需要指示剂,滴定终点是滴入最后一滴高锰酸钾溶液后溶液呈紫红色;
(5)在方法二中达到滴定终点读取数据时,俯视液面读取的标准液体积减小,测定结果偏低.
(2)加入盐酸是为了除去亚硫酸根离子排除亚硫酸根离子的干扰,测定硫酸钡沉淀质量更准确,
故答案为:Na2SO3全部转化成SO2,并使溶液呈酸性,排除SO32-的干扰;
(3)将方法一测定得到Na2SO3样品的纯度,25ml溶液中加入盐酸反应后加入氯化钡得到硫酸钡沉淀质量为bg,则依据硫元素守恒得到硫酸钠物质的量=
| bg |
| 233g/mol |
| 10b |
| 233 |
| ||
| a |
| 1420b |
| 233a |
| 1420b |
| 233a |
| 1420b |
| 233a |
(4)方法二是利用高锰酸钾溶液滴定溶液氧化亚硫酸钠实现定量测定,滴定过程中高锰酸钾溶液是紫红色溶液,不需要指示剂,滴定终点是滴入最后一滴高锰酸钾溶液后溶液呈紫红色,
故答案为:否;KMnO4本身可作指示剂,当KMnO4溶液过量时,溶液呈紫红色;
(5)在方法二中达到滴定终点读取数据时,俯视液面读取的滴定管中标准液体积减小,测定结果偏低,故答案为:偏低.

(12分)为测定某Na2SO3样品(含少量Na2SO4杂质)的纯度,实验室按以下步骤进行;① 称取ag样品,置于烧杯中;②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:
| 方法一 | 方法二 |
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量BaCl2溶液,充分搅拌,使沉淀完全; ⑥过滤、洗涤、干燥沉淀、称量得到bg固体。 | ④将25.00mL溶液置于锥形瓶中; ⑤用0.1 mol/L的酸性KMnO4溶液进行滴定,达到滴定终点时,消耗10.00mL溶液。 |
请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的的仪器是E和 (填字母);
(2)在方法一④中加入过量稀盐酸的目的是 ;
(3)在方法一测定得到Na2SO3样品的纯度是 (列出算式,可不化简);
(4)在方法二中,是否需要加入指示剂 (填“是”或“否”),请简述理由 ;
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果
(填“偏高”、“偏低”、“无影响”)。
(12分)为测定某Na2SO3样品(含少量Na2SO4杂质)的纯度,实验室按以下步骤进行;① 称取ag样品,置于烧杯中;②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:
|
方法一 |
方法二 |
|
④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量BaCl2溶液,充分搅拌,使沉淀完全; ⑥过滤、洗涤、干燥沉淀、称量得到bg固体。 |
④将25.00mL溶液置于锥形瓶中; ⑤用0.1 mol/L的酸性KMnO4溶液进行滴定,达到滴定终点时,消耗10.00mL溶液。 |
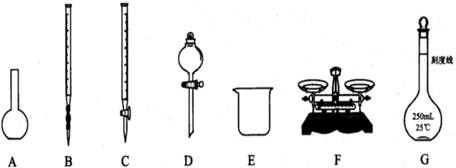
请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的的仪器是E和 (填字母);
(2)在方法一④中加入过量稀盐酸的目的是 ;
(3)在方法一测定得到Na2SO3样品的纯度是 (列出算式,可不化简);
(4)在方法二中,是否需要加入指示剂 (填“是”或“否”),请简述理由 ;
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果
(填“偏高”、“偏低”、“无影响”)。
为测定某Na2SO3样品(含少量Na2SO4杂质)的纯度,实验室按以下步骤进行;①称取ag样品,置于烧杯中;②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:
| 方法一 | 方法二 |
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量BaCl2溶液,充分搅拌,使沉淀完全; ⑥过滤、洗涤、干燥沉淀、称量得到bg固体. | ④将25.00mL溶液置于锥形瓶中; ⑤用0.1mol/L的酸性KMnO4溶液进行滴定,达到滴定终点时,消耗10.00mL溶液. |
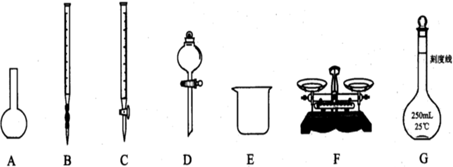
请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的仪器是E和______(填字母);
(2)在方法一④中加入过量稀盐酸的目的是______;
(3)在方法一测定得到Na2SO3样品的纯度是______(列出算式,可不化简);
(4)在方法二中,是否需要加入指示剂______(填“是”或“否”),请简述理由______;
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果______(填“偏高”、“偏低”、“无影响”).