题目内容
【题目】常温下,电解质溶液中的下列关系式不正确的是
A.已知A+H2B(过量)![]() HA+HB,则结合H+的能力:HB<A<B2
HA+HB,则结合H+的能力:HB<A<B2
B.在0.1 molL1的氨水中滴加0.1 molL1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH)=10a molL1
C.将c molL1的醋酸溶液与0.02 molL1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=![]()
D.将0.2 mol·L1盐酸与0.1 mol·L1的KAlO2溶液等体积混合,溶液中离子浓度由小到大的顺序:
c(Cl)>c(K+)>c(Al3+)>c(H+)>c(OH)
【答案】A
【解析】A.反应A+H2B(过量)![]() HA+HB的实质是H2B提供一个H+给A,而H2B转化为HB,说明结合H+的能力:HB<A,但从该反应不能判断结合H+的能力:A<B2,A不正确; B.0.1 molL1的氨水中滴加0.1 molL1盐酸,恰好完全中和时溶质为NH4Cl,pH=a,溶液的c(H+)=10a molL1均由水电离,因此水电离产生的c(OH)= c(H+)=10a molL1,B正确;C.常温下溶液呈中性,则c(H+)=107 mol·L1,根据电荷守恒c(CH3COO)+c(OH)=c(H+)+c(Na+)得c(CH3COO)=c(Na+)=0.01 mol·L1,根据物料守恒c(CH3COO)+ c(CH3COOH) =
HA+HB的实质是H2B提供一个H+给A,而H2B转化为HB,说明结合H+的能力:HB<A,但从该反应不能判断结合H+的能力:A<B2,A不正确; B.0.1 molL1的氨水中滴加0.1 molL1盐酸,恰好完全中和时溶质为NH4Cl,pH=a,溶液的c(H+)=10a molL1均由水电离,因此水电离产生的c(OH)= c(H+)=10a molL1,B正确;C.常温下溶液呈中性,则c(H+)=107 mol·L1,根据电荷守恒c(CH3COO)+c(OH)=c(H+)+c(Na+)得c(CH3COO)=c(Na+)=0.01 mol·L1,根据物料守恒c(CH3COO)+ c(CH3COOH) =![]() mol·L1得c(CH3COOH)=(
mol·L1得c(CH3COOH)=(![]() 0.01) mol·L1,代入Ka的表达式得Ka=
0.01) mol·L1,代入Ka的表达式得Ka=![]() =
=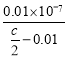 =
=![]() ,C正确;D.将0.2 mol·L1盐酸与0.1 mol·L1的KAlO2溶液等体积混合,即HCl与KAlO2按物质的量之比2:1反应,化学方程式为3KAlO2+6HCl
,C正确;D.将0.2 mol·L1盐酸与0.1 mol·L1的KAlO2溶液等体积混合,即HCl与KAlO2按物质的量之比2:1反应,化学方程式为3KAlO2+6HCl![]() 3KCl+AlCl3+2Al(OH)3↓,很明显c(Cl)>c(K+)>c(Al3+),再考虑Al3+水解使溶液显酸性,但水解程度小,可得出c(Al3+)>c(H+)>c(OH),故c(Cl)>c(K+)>c(Al3+)>c(H+)>c(OH),D正确。
3KCl+AlCl3+2Al(OH)3↓,很明显c(Cl)>c(K+)>c(Al3+),再考虑Al3+水解使溶液显酸性,但水解程度小,可得出c(Al3+)>c(H+)>c(OH),故c(Cl)>c(K+)>c(Al3+)>c(H+)>c(OH),D正确。




