题目内容
7.根据下图所示的信息,判断下列叙述不正确的是( )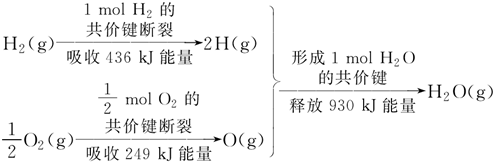
| A. | 1 mol H2的共价键形成放出436 kJ能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1 mol H2(g)跟$\frac{1}{2}$ mol O2(g)反应生成1 mol H2O(g)释放能量245 kJ | |
| D. | 1 mol H2(g)与$\frac{1}{2}$ mol O2(g)的总能量大于1 mol H2O(g)的能量 |
分析 A、依据信息中化学键的断裂吸收的能量等于形成该化学键放出的热量判断;
B、依据化学键的键能分析判断反应的热效应;
C、依据键能计算反应的热效应,反应物的键能之和减去生成物的键能之和分析判断;
D、依据键能计算反应的热效应,反应放热则反应物的总能量大于生成物的总能量.
解答 解:依据反应的热效应=反应物键能之和-生成物的键能之和=436KJ+249KJ-930KJ=-245KJ;所以反应是放热反应;热化学方程式为:H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol
A、因为化学键的断裂吸收的能量等于形成该化学键放出的热量,所以1 mol H2的共价键形成放出436 kJ能量,故A正确;
B、因为热化学方程式为:H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol,所以氢气与氧气反应生成水的同时放出能量,故B错误;
C、因为热化学方程式为:H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol,所以1molH2(g)与0.5molO2(g)反应生成1molH2O(g),释放能量245KJ,故C正确;
D、氢气与氧气反应生成水是放热反应,根据能量守恒,该反应的反应物的总能量大于生成物的总能量,故D正确;
故选B.
点评 本题考查了反应的热效应的计算依据和判断方法,反应的实质是拆化学键吸收热量,形成化学键放出热量,主要是依据化学键的键能来计算判断吸热反应和放热反应,关键是反应的热效应的计算是用反应物的键能之和减去生成物的键能之和.

练习册系列答案
相关题目
15. 下面如图的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来取名为Penguinone.下列有关Penguinone的说法正确的是( )
下面如图的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来取名为Penguinone.下列有关Penguinone的说法正确的是( )
 下面如图的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来取名为Penguinone.下列有关Penguinone的说法正确的是( )
下面如图的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来取名为Penguinone.下列有关Penguinone的说法正确的是( )| A. | Penguinone的分子式为C10H12O | |
| B. | Penguinone的同分异构体中不可能有芳香醛 | |
| C. | Penguinone分子1mol能与3molBr2发生加成反应 | |
| D. | .Penguinone分子中所有碳原子可能处于同一平面上 |
2.1973年世界十大科技新闻中报道:中国学者许志福和美国科学家穆尔共同合成了世界上最大的碳氢分子,其中一个分子由1134个碳原子和1146个氢原子构成.关于此物质,下列说法中错误的是( )
| A. | 是烃类化合物 | B. | 常温下呈固态 | ||
| C. | 具有类似金刚石的硬度 | D. | 分子中最多可能有281个碳碳叁键 |
19.用分液漏斗可以分离的一组混合物是( )
| A. | 乙酸乙酯和乙酸 | B. | 溴苯和水 | C. | 溴乙烷和乙醇 | D. | 乙醇和水 |
16.下列说法正确的是( )
| A. | NaHCO3可用于中和胃酸过多 | |
| B. | 硅用于制造光导纤维 | |
| C. | 氯气与澄清石灰水反应制漂白粉 | |
| D. | 医疗上通常直接用无水乙醇进行消毒 |
17.化学与生产、生活、社会密切相关.下列有关说法中不正确的是( )
| A. | 2008年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了化学中“焰色反应”的有关知识 | |
| B. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| C. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| D. | 人体需要的营养物质-蛋白质、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
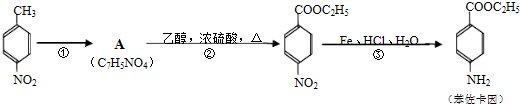
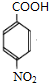 +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$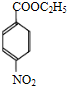 +H2O;
+H2O;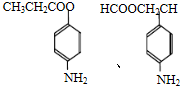 ,则剩余三种同分异构体的结构简式为:
,则剩余三种同分异构体的结构简式为: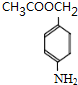 、
、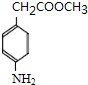 、
、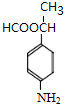 .
.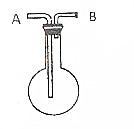 利用如图所示的装置收集以下7种气体(图中烧瓶位置不得移动)
利用如图所示的装置收集以下7种气体(图中烧瓶位置不得移动)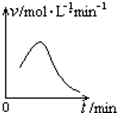 已知氯酸钾和亚硫酸氢钠发生氧化还原反应时,生成-1价的氯和+6价的硫的化合物,反应速率v和反应时间t的关系如图所示.
已知氯酸钾和亚硫酸氢钠发生氧化还原反应时,生成-1价的氯和+6价的硫的化合物,反应速率v和反应时间t的关系如图所示.