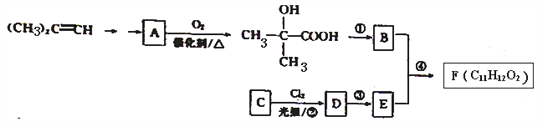
题目内容
【题目】[Cu(NH3)4]SO4 是常见的配合物。请回答下列问题:
(1)中心阳离子的核外价电子排布式为_______,S、O、N三种元素的第一电离能由大到小的顺序为________。
(2)SO42-的空间立体构型是_____,与SO42-互为等电子体的一种非极性分子____(填化学式)。
(3)若不考虑空间构型,[Cu(NH3)4]2+的结构可用示意图表示为______(箭头表示出配位键)
(4)Cu2O比CuO更稳定,试从原子结构的角度解释其原因________________。
(5)新制氢氧化铜悬浊液常用于检验醛基的存在,乙醛分子中碳原子的杂化方式为______。
(6)Cu2O的晶胞结构如图所示。

①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)C为(![]() ,
, ![]() ,
, ![]() )。则D原子的坐标参数为____它代表____原子。
)。则D原子的坐标参数为____它代表____原子。
②若Cu2O晶胞的棱长是a cm, 阿伏加德罗常数值为NA,求该晶体的密度__________。
【答案】 3d9 N>O>S 正四面体 CCl4(或SiCl4等) ![]() Cu2+价层电子为3d9,3d10为全充满状态更稳定 sp3 、 sp2 (
Cu2+价层电子为3d9,3d10为全充满状态更稳定 sp3 、 sp2 (![]() ;
; ![]() ;
; ![]() ) Cu
) Cu ![]()
【解析】(1)中心阳离子是铜离子,铜的原子序数是29,则铜离子的核外价电子排布式为3d9;非金属性越强,第一电离能越大,氮元素的2p轨道电子处于半充满状态,稳定性强,则S、O、N三种元素的第一电离能由大到小的顺序为N>O>S。(2)SO42-中S的价层电子对数是4,不存在孤对电子,其空间立体构型是正四面体;原子数和价电子数分别都相等的是等电子体,则与SO42-互为等电子体的一种非极性分子是CCl4或SiCl4。(3)[Cu(NH3)4]2+中氮元素提供孤对电子,与铜形成配位键,则其结构可用示意图表示为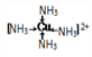 。(4)由于Cu2+价层电子为3d9,3d10为全充满状态更稳定,所以Cu2O比CuO更稳定;(5)乙醛分子的结构简式为CH3CHO,其中甲基中碳原子是饱和碳原子,是sp3杂化。醛基中碳原子形成碳氧双键,其杂化方式为sp2。(6)①根据晶胞结构和A、B、C的晶胞参数可知D原子的坐标参数为(1/4;1/4;1/4)。D原子全部在晶胞中,共计是4个,白球原子个数=8×1/8+1=2,根据氧化亚铜的化学式可知D代表Cu原子。②若Cu2O晶胞的棱长是a cm,阿伏加德罗常数值为NA,该晶体的密度=
。(4)由于Cu2+价层电子为3d9,3d10为全充满状态更稳定,所以Cu2O比CuO更稳定;(5)乙醛分子的结构简式为CH3CHO,其中甲基中碳原子是饱和碳原子,是sp3杂化。醛基中碳原子形成碳氧双键,其杂化方式为sp2。(6)①根据晶胞结构和A、B、C的晶胞参数可知D原子的坐标参数为(1/4;1/4;1/4)。D原子全部在晶胞中,共计是4个,白球原子个数=8×1/8+1=2,根据氧化亚铜的化学式可知D代表Cu原子。②若Cu2O晶胞的棱长是a cm,阿伏加德罗常数值为NA,该晶体的密度= 。
。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案