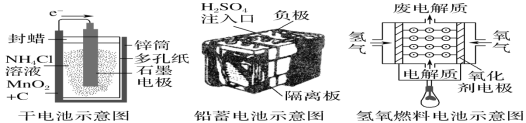
题目内容
【题目】下列有关离子共存的说法或离子方程式的书写中,正确的一组是( )
①加入NaOH溶液后的溶液中能大量共存的离子:NH4+、Al3+、SO42-
②pH=1的溶液中能大量共存的离子:Fe3+、Mg2+、Cl-、SO42-
③能使酚酞溶液变红的溶液中能大量共存的离子:K+、CO32-、Na+、S2-
④向 NH4HCO3溶液中加入足量NaOH溶液并共热:NH4++OH-=NH3↑+H2O
⑤用食醋溶解水垢:CaCO3+2H+=Ca2+ + CO2↑ + H2O
⑥向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
⑦用FeCl3溶液腐蚀铜电路板:2Fe3++Cu=2Fe2++Cu2+
A.①③⑤⑦B.②③⑥⑦C.②④⑤⑦D.③④⑥⑦
【答案】B
【解析】
根据不同条件下的离子相互反应进行判断,注意弱电解质在离子方程式书写时不能拆分。
①加入NaOH溶液后的溶液显碱性,OH-能分别与NH4+、Al3+反应,则NH4+、Al3+不能大量存在,故①错误;
②pH=1的溶液呈酸性,该组离子之间不反应、与H+不反应,则能大量共存的离子,故②正确;
③能使酚酞溶液变红的溶液中存在OH-,该组离子相互间不反应、与OH-均不反应,则能大量共存,故③正确;
④NH4HCO3溶液加入足量NaOH溶液共热生成碳酸钠、氨气和水,则离子反应为HCO3-+NH4++2OH-![]() NH3↑+2H2O+CO32-,故④错误;
NH3↑+2H2O+CO32-,故④错误;
⑤用食醋溶解水垢的离子反应为CaCO3+2CH3COOH=Ca2++CO2↑+H2O+2CH3COO-,故⑤错误;
⑥硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7,反应生成硫酸钡、硫酸钠和水,离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故⑥正确;
⑦用FeCl3溶液腐蚀铜电路板的离子反应为2Fe3++Cu═2Fe2++Cu2+,遵循电荷守恒和质量守恒定律,故⑦正确;
答案为B。