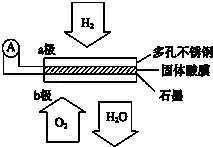
��Ŀ����
����Ŀ���ȼ��ⱥ��ʳ��ˮ��ȡNaOH��Һ�Ĺ�������ʾ��ͼ��ͼ1�����������գ� 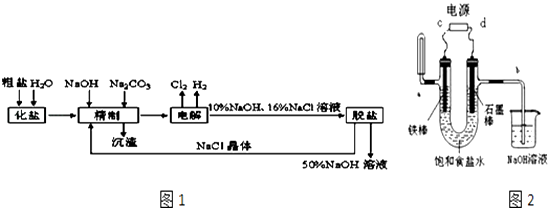
��1���ڵ������У����Դ���������ĵ缫�ϵ缫��ӦΪ �� ���Դ���������ĵ缫��������ҺpH��ѡ����䡱�������ߡ����½�������
��2����ҵʳ�κ�Ca2+��Mg2+�����ʣ����ƹ��̷�����Ӧ�����ӷ���ʽΪ �� ��
��3�����������SO42�������ϸߣ��������ӱ��Լ���ȥSO42�� �� �ñ��Լ������� ��
A.BaCl2
B.Ba��NO3��2
C.BaCO3
��4��������ͼ2װ�õ�ⱥ��ʳ��ˮʱa���ռ�����������U�������������������ɫʯ����ɫ�仯Ϊ �� CΪ��Դ������B���������в���������������飮
��5������㹻��ʱ�������ͬ������a����b����������������Ƚӽ�2��1����ʱ����Դ������������U���������� ��
���𰸡�
��1��2H++2e��=H2�����½�
��2��Ca2++CO32���TCaCO3����Mg2++2OH���TMg��OH��2��
��3��A
��4��H2�����������������۵⻯����ֽ
��5���ȳ��ְ�ɫ��������ת��Ϊ���ɫ����
���������⣺��1������Ȼ�����Һʱ��������������ʧ�������������Ĺ��̣��缫��ӦʽΪ2Cl����2e��=Cl2�����õ缫���ɵ����������ܽ���ˮ��Ӧ�����ᣬ�缫����PH�½��������������ӵĵ������������Ĺ��̣������缫��Ӧ��2H++2e��=H2�����ü����������ӣ��缫������ҺpH���ߣ����Դ��ǣ�2H++2e��=H2�����½���
��2.��Ca2+��Mg2+��������̼���ơ�NaOH��Ӧת��Ϊ���������ӷ�Ӧ�ֱ�ΪCa2++CO32���TCaCO3����Mg2++2OH���TMg��OH��2�������Դ��ǣ�Ca2++CO32���TCaCO3����Mg2++2OH���TMg��OH��2����
��3.�����������SO42�������ϸߣ��������ӱ��Լ���ȥSO42�� �� �ñ��Լ�ѡ���ԭ���Dz��������Գ�ȥ���������ӣ�A��BaCl2 �� ��������Լ����������ȫ�������������Ӳ����������ӣ���A���ϣ�B��Ba��NO3��2 �� ��������Լ�����������Ӳ��ܳ�ȥ�����������������������B�����ϣ�C��BaCO3Ϊ������ˮ���Σ�����������Ӽ�������Ӧ����C�����ϣ�
���Դ��ǣ�A��
��4.������ͼʾ��̬������ռ�������֪��a���Թ����ռ����������������������ӵĵ������������Ĺ��̣������缫��Ӧ��2H++2e��=H2�����ü����������ӣ��缫��������������Ũ����������ɫʯ����ɫ����ʾ��ɫ�����Դ��������Ϊ������CΪ��Դ�ĸ�����������������ʧ�������������Ĺ��̣��缫��ӦʽΪ2Cl����2e��=Cl2������������ʹʪ��ĵ��۵⻯����ֽ����ɫ������ʽΪ2KI+Cl2=2KCl+I2 �� ���ɵĵⵥ���������ʾ��ɫ�����Դ��ǣ����������������۵⻯����ֽ��
��5.������㹻��ʱ�������ͬ������a����b����������������Ƚӽ�2��1����ʱΪ���ˮ������Ϊ�������ƣ�a���Թ����ռ�����������Ϊ���������Դ��������������Դ�����������������������缫��ӦΪ��2Fe��4e��=2Fe2+ �� ����ʯī���缫��ӦΪ��2H2O+O2+4e��=4OH�� �� �ܷ�ӦΪ2Fe+2H2O+O2�T2Fe��OH��2 �� ���ְ�ɫ��������ɫ�������������������������ɺ��ɫ��������������ӦΪ��4Fe��OH��2+2H2O+O2�T4Fe��OH��3 �� ��������Ϊ���ȳ��ְ�ɫ��������ת��Ϊ���ɫ������
���Դ��ǣ��ȳ��ְ�ɫ��������ת��Ϊ���ɫ������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ƻ��iPad��iPhone�����й���������137��ƻ����˾פ�й���Ӧ������Ա����ȴ���ڱ�¶�������黷���У��������ܲ���Ӱ�죮ijͬѧ�����е�ߵͽ������������У���֪����5�������Ѱ��е��ɵ͵���˳�����У���������������ܲ����λ���ǣ� ��
1 | 2 | 3 | 4 | 5 |
���� | ��ϩ | ���� | 2�������� | �ױ� |
A.�ۢ�֮��
B.�ڢ�֮��
C.�ܢ�֮��
D.��֮��