题目内容
14.实验室要配制含有0.17mol K2SO4、0.16mol KCl、0.5mol NaCl的混合溶液1L,现因无K2SO4,只有Na2SO4、NaCl、KCl.问如何配制所需溶液?简述操作步骤.分析 以Na2SO4、NaCl、KCl和1L水为原料配得相同组成的溶液,要计算所需Na2SO4、NaCl、KCl物质的量,应从离子的物质的量的相等的角度进行计算.
解答 解:0.17mol K2SO4、0.16mol KCl、0.5mol NaCl中,
n(K+)=0.16mol+0.17mol×2=0.5mol;
n(Na+)=0.5mol;
n(Cl-)=0.5mol+0.16mol=0.66mol;
n(SO42-)=0.17mol,
现用Na2SO4、NaCl、KCl和1LH2O为原料配得相同组成的营养液,根据SO42-离子守恒可知:则需n(Na2SO4)=0.17mol;质量为:0.17mol×142g/mol≈24.1g;
然后根据Na+的守恒可知:n(NaCl)=0.5mol-0.17mol×2=0.16mol;质量为:0.16mol×58.5g/mol=9,36g≈9.4g;
最后根据氯离子的守恒可知:n(KCl)=0.66mol-0.16mol=0.5mol,质量为:0.5mol×74.5g/mol=37.25g≈37.3g;
配制过程为:用托盘天平分别称量硫酸钠24.1g,氯化钠9.4g,氯化钾37.3g,置于烧杯中加水不断溶解,冷却后,转移到1L容量瓶中,洗涤烧杯和玻璃棒洗涤液全部转移容量瓶,然后进行定容,摇匀,装瓶,贴标签;
故答案为:用托盘天平分别称量硫酸钠24.1g,氯化钠9.4g,氯化钾37.3g,置于烧杯中加水不断溶解,冷却后,转移到1L容量瓶中,洗涤烧杯和玻璃棒洗涤液全部转移容量瓶,然后进行定容,摇匀,装瓶,贴标签;
点评 本题考查了一定物质的量浓度溶液的配制,涉及物质的量有关计算,抓住离子个数守恒是解题关键,题目难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案
相关题目
4.3.01×1023个CO2的物理量还可以是( )
①11.2L ②0.5mol ③1.5mol ④22g.
①11.2L ②0.5mol ③1.5mol ④22g.
| A. | ①② | B. | ①②④ | C. | ①④ | D. | ②④ |
9.对一甲乙苯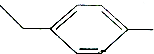 的一氯代物(不考虑立体异构)共有( )
的一氯代物(不考虑立体异构)共有( )
 的一氯代物(不考虑立体异构)共有( )
的一氯代物(不考虑立体异构)共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
9.碳酸锰[MnCO3]常用制造铁氧磁体,也用于化肥添加剂.某化学研究课题组组拟从废旧干电池回收制取碳酸锰.
①将干电池剖切、分选得到黑色混合物(主要成份为MnO2)洗涤、过滤、烘干.
②将上述固体按固液体积比1:4.5加入浓盐酸,反应完全后过滤,浓缩.
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰.
(1)写出第②步反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)请说出第②步反应中产生气体的一种用途杀菌、消毒、制造漂白粉、有机化工合成等.如图1在进行过滤时,操作有何错误:没有使用玻璃棒引流.
(3)查阅文献,发现上反应第③步中除了生成MnCO3之外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长易被氧化成褐色的MnO(OH)2,MnCO3和MnO(OH)2受热最终均分解氧化成MnO2,该课题组对上述沉淀的成份提出以下假设,请帮助他完成假设:
假设一:全部为MnCO3
假设二:全部为Mn(OH)2
假设三:既有MnCO3也有Mn(OH)2 …
(4)①为验证假设二是否正确,该课题组进行了以下研究:
定性研究:请完成下表中的内容
②定量研究:将所得沉淀过滤、洗涤,置于空气中充分氧化后,小心干燥,取22.0g样品,加热,测得固体质量随温度的变化关系如图2.根据图中数据判断假设三成立,理由是:300℃以后质量增加量为MnO氧化为MnO2,计算可得MnCO3质量为11.5g 或Mn(OH)2质量为10.5g,所以既有MnCO3 也有Mn(OH)2.

①将干电池剖切、分选得到黑色混合物(主要成份为MnO2)洗涤、过滤、烘干.
②将上述固体按固液体积比1:4.5加入浓盐酸,反应完全后过滤,浓缩.
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰.
(1)写出第②步反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)请说出第②步反应中产生气体的一种用途杀菌、消毒、制造漂白粉、有机化工合成等.如图1在进行过滤时,操作有何错误:没有使用玻璃棒引流.
(3)查阅文献,发现上反应第③步中除了生成MnCO3之外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长易被氧化成褐色的MnO(OH)2,MnCO3和MnO(OH)2受热最终均分解氧化成MnO2,该课题组对上述沉淀的成份提出以下假设,请帮助他完成假设:
假设一:全部为MnCO3
假设二:全部为Mn(OH)2
假设三:既有MnCO3也有Mn(OH)2 …
(4)①为验证假设二是否正确,该课题组进行了以下研究:
定性研究:请完成下表中的内容
| 实验步骤(不要求写出具体操作过程) | 与其的实验现象和结论 |
| 将所得沉淀过滤、洗涤… | 颜色变成褐色,说明含有Mn(OH)2 |
| 取少量沉淀于试管中,假如足量的盐酸,观察现象 | 没有气泡生成,说明不含MnCO3 |