题目内容
【题目】工业上通过电化学原理在铝表面形成氧化膜来提高其抗腐蚀能力,工作原理如图所示。下列说法不正确的是

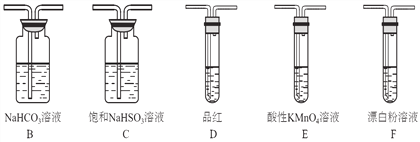
A. 碳棒可用铜棒代替,其作用是传递电流
B. 通电一段时间后,溶液的pH减小
C. 通电后电子被强制从碳棒流向铝片使铝表面形成氧化膜
D. 可通过调节滑动变阻器来控制氧化膜的形成速度
【答案】C
【解析】A、根据电解原理,碳棒为阴极,铜棒能够代替碳棒,作用是传递电流,故A说法正确;B、阳极反应式为2Al-6e-+3H2O=Al2O3+6H+,阴极反应式为2H++2e-=H2↑,总电解反应式为2Al+3H2O![]() Al2O3+3H2↑,硫酸浓度增大,c(H+)增大,即pH减小,故B说法正确;C、电子移动方向是从电源的负极→碳棒,铝片→电源的正极,电解质溶液中没有电子通过,故C说法错误;D、滑动变阻器调节电路中电流的强度,即可以控制氧化膜的形成速度,故D说法正确。
Al2O3+3H2↑,硫酸浓度增大,c(H+)增大,即pH减小,故B说法正确;C、电子移动方向是从电源的负极→碳棒,铝片→电源的正极,电解质溶液中没有电子通过,故C说法错误;D、滑动变阻器调节电路中电流的强度,即可以控制氧化膜的形成速度,故D说法正确。

 开心练习课课练与单元检测系列答案
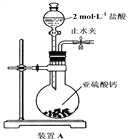
开心练习课课练与单元检测系列答案【题目】铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:
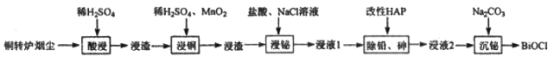
请回答:
(1)Bi位于第六周期,其原子结构示意图为__________________________________。
(2)向“酸浸”所得浸液中加入Zn粉,充分反应后过滤,从溶液中获得ZnSO4·7H2O的操作为__________、过滤、洗涤、干燥。
(3)“浸铜”时,有单质硫生成,其离子方程式为____________________________。
(4)“浸铋”时,温度升高,铋的浸出率降低,其原因为____________________________。
(5)“除铅、砷”时,可以采用以下两种方法。
①加入改性HAP。浸液1与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
L/S | 125:1 | 50:1 | 25:1 | 15:1 |
Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
As3+去除率/% | 98.79 | 98.92 | 98.34 | 99.05 |
m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
实验中应采用的L/S=_________________________。
②铁盐氧化法,向浸液1中加入Fe2(SO4)3,并调节pH,生成FeAsO4沉淀。欲使溶液中c(AsO42-)<10-9mol/L且不产生Fe(OH)3沉淀,应控制pH的范围为__________。
已知:1g2=0.3:;FeAsO4、Fe(OH)3的Ksp分别为5×10-23、4×10-38。
(6)“沉铋“时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为___________________。