题目内容
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
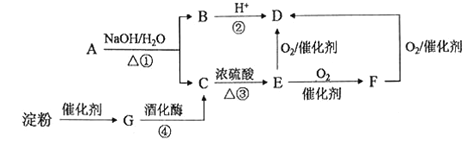
A. NaCl ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
B. Cu ![]() CuS
CuS ![]() CuCl2
CuCl2
C. Fe2O3 ![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
D. MgCO3![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
【答案】A
【解析】
A. 饱和食盐水中通入氨气、二氧化碳会发生反应生成碳酸氢钠晶体,碳酸氢钠加热分解生成碳酸钠;B.Cu与S反应生成Cu2S;C.直接蒸发FeCl3溶液得Fe(OH)3固体;D.电解MgCl2溶液不能制得金属Mg。
A. 饱和食盐水中通入氨气、二氧化碳会发生反应生成碳酸氢钠晶体,碳酸氢钠加热分解生成碳酸钠,NaCl ![]() NaHCO3
NaHCO3 ![]() Na2CO3物质间的转化均能实现,A项符合题意;
Na2CO3物质间的转化均能实现,A项符合题意;
B.Cu与S在点燃条件下反应生成Cu2S,不能生成CuS,转化关系不能实现,B项不符合题意;
C.氧化铁与盐酸反应得氯化铁溶液,直接蒸发氯化铁溶液,会促进铁离子水解生成氢氧化铁,应在HCl气流中加热蒸发制无水氯化铁,C项不符合题意;
D.电解氯化镁溶液时,阳极上Cl-放电生成Cl2,阴极上H+放电生成H2和Mg(OH)2,转化关系不能实现,D项不符合题意,答案选A。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】活性氧化锌是一种多功能性的新型无机材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
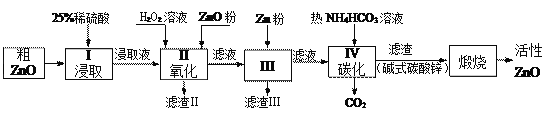
已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
完成下列填空:
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要_____(选填编号)
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤II中加入H2O2溶液的作用是_________________________(用离子方程式表示);
(3)用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是_______________________。
(4)步骤III中加入Zn粉的作用是:①__________________;②进一步调节溶液pH。
(5)碱式碳酸锌[Zn2(OH)2 CO3]煅烧的化学方程式为________________________________。
(6)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
① 取1.000g活性氧化锌,用15.00mL 1.000mol·L-1 硫酸溶液完全溶解,滴入几滴甲基橙。② 用浓度为0.5000mol·L-1 的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL。判断滴定终点的方法是________;所得活性氧化锌的纯度为________(相对原子质量 O-16 Zn-65 )。