题目内容
(16分)某只含有CaCl2和Na2SO4杂质的粗盐样品,加水得到混合物A后,某实验小组的同学设计了如下实验步骤,请按要求回答有关问题。
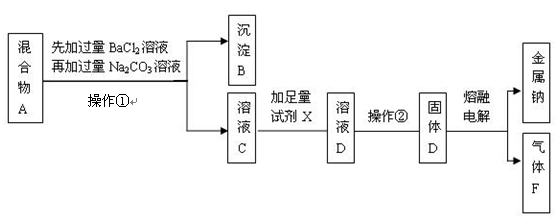
(1)在混合物A中先加过量的BaCl2溶液除去的离子是 ;充分搅拌后,再加过量的Na2CO3溶液可除去的离子是 。
(2)在溶液C中加入的足量试剂X是 。
(3)操作②的分离方法分别是 。
(4)漂白液的有效成分是NaClO,可用气体F与NaOH溶液反应制得,该反应的化学方程式为 。

(1)在混合物A中先加过量的BaCl2溶液除去的离子是 ;充分搅拌后,再加过量的Na2CO3溶液可除去的离子是 。
(2)在溶液C中加入的足量试剂X是 。
(3)操作②的分离方法分别是 。
(4)漂白液的有效成分是NaClO,可用气体F与NaOH溶液反应制得,该反应的化学方程式为 。
(1)SO42-;Ba2+,Ca2+(2)HCl溶液(3)蒸发结晶
(4)Cl2+ 2NaOH="=NaCl" +NaClO +H2O
(4)Cl2+ 2NaOH="=NaCl" +NaClO +H2O
试题分析:(1)氯化钡能与硫酸钠反应生成硫酸钡沉淀和氯化钠,因此加入氯化钡溶液是除去硫酸钠的;碳酸钠能与氯化钙反应产生碳酸钙沉淀,能与氯化钡反应产生碳酸钡沉淀,因此加入碳酸钠溶液的目的是除去原混合物中的氯化钙以及过量的氯化钡;
(2)溶液C中含有过量的碳酸钠和氯化钠,加入试剂x将碳酸钠转化成氯化钠,因此加入的x是盐酸,反应的化学方程式为2HCl+Na2CO2=2NaCl+CO2↑+H2O;
(3)操作①是将固体与液体分离,用过滤法,操作②是将氯化钠溶液中氯化钠结晶析出,应用蒸发溶剂的方法.
(4)Cl2与NaOH溶液反应方程式为:Cl2+ 2NaOH="=NaCl" +NaClO +H2O。
点评:本题主要考了在粗盐提纯的试验中对杂质进行转换的探究,除去杂质的同时不能引入新的杂质。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 已知:①Fe3+、Al3+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2和12.4;Al(OH)3完全溶解的pH为11.8。②常温下,饱和氨水的pH约为11。
已知:①Fe3+、Al3+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2和12.4;Al(OH)3完全溶解的pH为11.8。②常温下,饱和氨水的pH约为11。