题目内容
下列描述不正确的是
A.碳原子核外电子有六种运动状态 B.NH4+中N原子轨道杂化类型为sp3
C.电负性:O > Cl D.第一电离能 Al > Mg
【答案】
D
【解析】
试题分析:碳原子核外电子有6个,则就有六种运动状态,A正确;NH4+是正四面体型结构,N原子最外层电子全部参与成键,所以氮原子的轨道杂化类型为sp3杂化,B正确;非金属性越强,电负性越大,氧元素的非金属性强于氯元素的,则电负性是氧元素的大于氯元素的,C正确;金属性越强,第一电离能越小,但由于镁原子的3s轨道电子处于半充满状态,稳定性强,第一电离能大于铝的第一电离能,D不正确,答案选D。
考点:考查核外电子排布、杂化轨道类型、电负性和第一电离能的判断
点评:该题是高考中的常见考点,属于基础性试题的考查。试题紧扣教材基础,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于提高学生的应试能力和学习效率。

练习册系列答案
相关题目
镍(Ni)-镉(Cd)可充电电池,放电时的电极反应是:Cd+2OH--2e-?Cd(OH)2;2NiO(OH)+2H2O+2e-?2Ni(OH)2+2OH-.下列描述不正确的是( )
| A、电池的总反应是:Cd+2NiO(OH)+2H2O?2Ni(OH)2+Cd(OH)2 | B、电池充电时,镉元素被还原 | C、电池放电时,电池负极周围溶液的pH不断减小 | D、电池充电时,阳极上的Ni(OH)2不断增加 |
如图,下列描述不正确的是( )
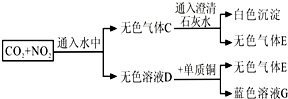

| A、C的成分是气体E与二氧化碳的混和气体 | B、浓热的D溶液能把碳单质氧化为二氧化碳 | C、气体E遇空气会被氧化成红棕色的气体 | D、溶液G是蓝色的硫酸铜溶液 |
一定条件下的CO和O2的混合气体,其密度是相同条件下H2的15倍,下列描述不正确的是( )
| A、混合气体中CO和O2的质量之比1:1 | B、混合气体中CO和O2的物质的量之比1:1 | C、混合气体中CO和O2的分子数之比1:1 | D、混合气体中CO和O2的体积之比1:1 |