题目内容
(12分)A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)D元素在元素周期表中的位置 ,该元素常见氧化物有 和 (写出化学式)
(2)写出B、C单质生成E的化学方程式: 。
(3)12克A单质充分燃烧后的产物通人1L 1mol/LNaOH溶液中,所得溶液的溶质为 ,其物质的量为 mol。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式
(1)D元素在元素周期表中的位置 ,该元素常见氧化物有 和 (写出化学式)
(2)写出B、C单质生成E的化学方程式: 。
(3)12克A单质充分燃烧后的产物通人1L 1mol/LNaOH溶液中,所得溶液的溶质为 ,其物质的量为 mol。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式
(1)第三周期第ⅥA族 (2分) SO2(1分) SO3(1分)
(2)2Na+O2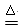 Na2O2(2分)
Na2O2(2分)
(3)NaHCO3、 1 (每空2分,共4分)
(4)C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O(2分)
(2)2Na+O2
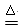 Na2O2(2分)
Na2O2(2分)(3)NaHCO3、 1 (每空2分,共4分)
(4)C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O(2分)
试题分析:(1)淡黄色的固体E是过氧化钠,所以B是O元素,C是Na元素;A原子的最外层上有4个电子,且A的原子序数比B小,所以A是C元素;D的L层电子数等于K、M两个电子层上的电子数之和L层上有8个电子,K层有2个电子,所以M层有6个电子,D是S元素。S位于周期表的第三周期第ⅥA族;该元素常见氧化物有SO2、SO3
(2)钠与氧气加热生成过氧化钠,化学方程式为2Na+O2
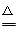 Na2O2
Na2O2(3)12克C单质的物质的量是1mol,生成二氧化碳为1mol,与1mol的NaOH反应,根据元素守恒,生成1mol碳酸氢钠,化学式为NaHCO3;
(4)D的最高价氧化物的水化物是硫酸,浓硫酸与C反应,化学方程式为C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目

 与R-可发生反应:RO
与R-可发生反应:RO