题目内容
20.重金属离子Cu2+、Ba2+等均有毒.实验室有甲、乙两种废液,均有一定毒性.甲废液经化验呈碱性,主要有毒离子为Ba2+离子.如将甲、乙两废液按一定比例混合,毒性明显降低.乙废液中可能含有的离子是( )| A. | Cu2+、Cl- | B. | Cu2+、SO42- | C. | Na+、SO42- | D. | Ag+、NO3- |
分析 甲废液经化验呈碱性,主要有毒离子为Ba2+离子,则甲中含Ba2+、OH-,乙中含Cu2+,甲、乙两废液按一定比例混合,毒性明显降低,则应混合生成氢氧化铜沉淀、硫酸钡沉淀,以此来解答.
解答 解:甲废液经化验呈碱性,主要有毒离子为Ba2+离子,则甲中含Ba2+、OH-,乙中含Cu2+,甲、乙两废液按一定比例混合,毒性明显降低,则应混合生成氢氧化铜沉淀、硫酸钡沉淀,乙废液中可能含有的离子是Cu2+、SO42-,
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
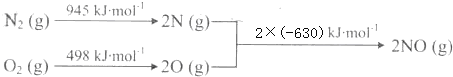
10.已知:H2S在与不足量的O2反应时,生成S和H2O.根据以下三个热化学方程式:
2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H1
2H2S(g)+O2(g)═2S(s)+2H2O(l)△H2
2H2S(g)+O2(g)═2S(s)+2H2O(g)△H3
判断△H1、△H2、△H3三者大小关系正确的是( )
2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H1
2H2S(g)+O2(g)═2S(s)+2H2O(l)△H2
2H2S(g)+O2(g)═2S(s)+2H2O(g)△H3
判断△H1、△H2、△H3三者大小关系正确的是( )
| A. | △H3>△H2>△H1 | B. | △H1>△H3>△H2 | C. | △H1>△H2>△H3 | D. | △H2>△H1>△H3 |
11.住宅建设需大量的建筑材料,下列物质不属于硅酸盐材料的是( )
| A. | 水泥 | B. | 石灰石 | C. | 玻璃 | D. | 陶瓷 |
8.配制250mL 0.1mol•L-1的盐酸时,下列实验操作使所配溶液浓度偏大的是( )
| A. | 用量筒量取所需的浓盐酸时俯视刻度线 | |
| B. | 定容时仰视刻度线 | |
| C. | 用量筒量取所需浓盐酸倒入烧杯后,用水洗涤量筒2~3次,洗涤液倒入烧杯中 | |
| D. | 定容后倒转容量瓶几次,发现凹液面最低点低于刻度线,再补几滴蒸馏水 |
5.下列关于84消毒剂(主要成分是NaClO)的使用和保存不正确的是( )
| A. | 将消毒液放在阴凉、避光的地方 | |
| B. | 84消毒剂也可用于漂白 | |
| C. | 在使用时,要适当稀释,消毒液不是越浓越好 | |
| D. | 可与洁厕剂(含有盐酸)混合使用 |
9.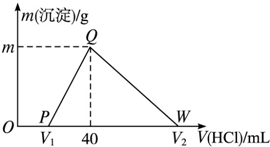 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol•L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )| A. | 原合金质量为0.92g | B. | 图中V2为60 | ||
| C. | 沉淀的质量m为1.56g | D. | OP段发生的反应为:OH-+H+═H2O |