题目内容
有镁、铝混合粉末10.2g,将它溶于600mL 2mol?L-1的盐酸中,若要使沉淀质量达到最大值,则需加入2mol?L-1氢氧化钠溶液的体积为
- A.120 mL
- B.600 mL
- C.1200 mL
- D.1800 mL
B
分析:加入2mol?L-1的氢氧化钠溶液,并使得沉淀达到最大量,此时溶液中只有氯化钠,根据氯元素守恒n(NaCl)=n(HCl),根据n=cV计算n(HCl),由钠元素守恒n(NaCl)=n(NaOH),再根据V=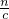 计算需要氢氧化钠溶液的体积.
计算需要氢氧化钠溶液的体积.
解答:加入2mol?L-1的氢氧化钠溶液,并使得沉淀达到最大量,此时溶液中只有氯化钠,
根据氯元素守恒n(NaCl)=n(HCl)=0.6L×2mol?L-1=1.2mol,
由钠元素守恒n(NaOH)=n(NaCl)=1.2mol,
故需要氢氧化钠溶液的体积为 =0.6L=600mL,
=0.6L=600mL,
故选B.
点评:本题考查混合物的有关计算、镁铝的性质,难度不大,注意利用守恒进行计算,判断最后溶液中溶质是氯化钠是关键.
分析:加入2mol?L-1的氢氧化钠溶液,并使得沉淀达到最大量,此时溶液中只有氯化钠,根据氯元素守恒n(NaCl)=n(HCl),根据n=cV计算n(HCl),由钠元素守恒n(NaCl)=n(NaOH),再根据V=
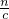 计算需要氢氧化钠溶液的体积.
计算需要氢氧化钠溶液的体积.解答:加入2mol?L-1的氢氧化钠溶液,并使得沉淀达到最大量,此时溶液中只有氯化钠,
根据氯元素守恒n(NaCl)=n(HCl)=0.6L×2mol?L-1=1.2mol,
由钠元素守恒n(NaOH)=n(NaCl)=1.2mol,
故需要氢氧化钠溶液的体积为
 =0.6L=600mL,
=0.6L=600mL,故选B.
点评:本题考查混合物的有关计算、镁铝的性质,难度不大,注意利用守恒进行计算,判断最后溶液中溶质是氯化钠是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目