题目内容
有2份质量分数不同的NaHCO3和NaOH的混合物,将它们分别用酒精灯加热至恒重测得的数据如下:
| 第1份 | 第2份 | |
| 混合物质量(g) | 9.2 | 18.4 |
| 反应后固体质量(g) | 8.3 | 15.6 |
- A.本次实验至少要进行6次称重
- B.第1份混合物中NaOH的质量分数更大
- C.根据表中数据不能计算出第1份混合物中NaHCO3的质量分数
- D.第2份混合物中NaOH的质量分数小于32%
BD
分析:每一份混合物在加热之前要称重,加热过程中为了确定是否已加热至恒重至少称重两次,氢氧化钠是强碱有强腐蚀性,所以要放在烧杯中称量,从而确定至少称量的次数.当氢氧化钠和碳酸氢钠恰好反应时,剩余固体为碳酸钠,减少的质量为水的质量;当碳酸氢钠过量时,氢氧化钠和部分碳酸氢钠反应生成碳酸钠和水,剩余的碳酸氢钠分解生成碳酸钠、水、二氧化碳,所以减少的质量为水和二氧化碳的质量;当氢氧化钠过量时,剩余固体为碳酸钠和氢氧化钠,减少的质量为水的质量,根据以上分析选项的正误.
解答:氢氧化钠是强碱有强腐蚀性,所以要放在烧杯中称量,首先要称量烧杯的质量;每一份混合物在加热之前要称重,加热过程中为了确定是否已加热至恒重至少称重两次,所以每份药品至少要称量3次,可使用同一只烧杯称量药品,所以本次实验至少要进行7次称重;
混合物加热发生的反应如下:NaHCO3+NaOH=Na2CO3+H2O,2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
当碳酸氢钠和氢氧化钠恰好反应时,生成物是碳酸钠和水,加热条件下,水被蒸发,所以减少的质量为水的质量,减少的质量分数为: =14.5%,氢氧化钠的质量分数为:
=14.5%,氢氧化钠的质量分数为: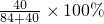 =32%;
=32%;
当碳酸氢钠过量时,减少的质量除了碳酸氢钠和氢氧化钠生成的水之外,还有剩余的碳酸氢钠分解生成的水和二氧化碳,所以减少的质量分数大于14.5%,氢氧化钠的质量分数小于32%;
当氢氧化钠过量时,减少的质量为碳酸氢钠和氢氧化钠生成的水的质量,氢氧化钠剩余,所以减少的质量分数小于
14.5%,氢氧化钠的质量分数大于32%;
A、本次实验至少要进行7次称重,故A错误;
B、第1份混合物中减少的质量分数为: =9.8%<14.5%,所以氢氧化钠过量,氢氧化钠的质量分数大于32%,第2份混合物的质量是第1份的2倍,如果两份氢氧化钠的质量分数相等,第2份反应后固体质量应为16.6g,但实际小于16.6g,所以是碳酸氢钠过量,氢氧化钠的质量分数小于32%,故B正确.
=9.8%<14.5%,所以氢氧化钠过量,氢氧化钠的质量分数大于32%,第2份混合物的质量是第1份的2倍,如果两份氢氧化钠的质量分数相等,第2份反应后固体质量应为16.6g,但实际小于16.6g,所以是碳酸氢钠过量,氢氧化钠的质量分数小于32%,故B正确.
C、根据表中数据能计算出第1份混合物中NaHCO3的质量分数,故C错误.
D、第2份混合物中减少的质量分数为: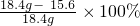 =15.2%>14.5%,所以氢氧化钠不足量,氢氧化钠的质量分数小于32%,故D正确;
=15.2%>14.5%,所以氢氧化钠不足量,氢氧化钠的质量分数小于32%,故D正确;
故选BD.
点评:本题考查了钠的化合物的性质,难度较大,易错选项是A,因漏掉称量烧杯的次数而选A选项,注意碳酸氢钠和氢氧化钠的过量计算,从而选取正确选项.
分析:每一份混合物在加热之前要称重,加热过程中为了确定是否已加热至恒重至少称重两次,氢氧化钠是强碱有强腐蚀性,所以要放在烧杯中称量,从而确定至少称量的次数.当氢氧化钠和碳酸氢钠恰好反应时,剩余固体为碳酸钠,减少的质量为水的质量;当碳酸氢钠过量时,氢氧化钠和部分碳酸氢钠反应生成碳酸钠和水,剩余的碳酸氢钠分解生成碳酸钠、水、二氧化碳,所以减少的质量为水和二氧化碳的质量;当氢氧化钠过量时,剩余固体为碳酸钠和氢氧化钠,减少的质量为水的质量,根据以上分析选项的正误.
解答:氢氧化钠是强碱有强腐蚀性,所以要放在烧杯中称量,首先要称量烧杯的质量;每一份混合物在加热之前要称重,加热过程中为了确定是否已加热至恒重至少称重两次,所以每份药品至少要称量3次,可使用同一只烧杯称量药品,所以本次实验至少要进行7次称重;
混合物加热发生的反应如下:NaHCO3+NaOH=Na2CO3+H2O,2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O当碳酸氢钠和氢氧化钠恰好反应时,生成物是碳酸钠和水,加热条件下,水被蒸发,所以减少的质量为水的质量,减少的质量分数为:
 =14.5%,氢氧化钠的质量分数为:
=14.5%,氢氧化钠的质量分数为: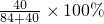 =32%;
=32%;当碳酸氢钠过量时,减少的质量除了碳酸氢钠和氢氧化钠生成的水之外,还有剩余的碳酸氢钠分解生成的水和二氧化碳,所以减少的质量分数大于14.5%,氢氧化钠的质量分数小于32%;
当氢氧化钠过量时,减少的质量为碳酸氢钠和氢氧化钠生成的水的质量,氢氧化钠剩余,所以减少的质量分数小于
14.5%,氢氧化钠的质量分数大于32%;
A、本次实验至少要进行7次称重,故A错误;
B、第1份混合物中减少的质量分数为:
 =9.8%<14.5%,所以氢氧化钠过量,氢氧化钠的质量分数大于32%,第2份混合物的质量是第1份的2倍,如果两份氢氧化钠的质量分数相等,第2份反应后固体质量应为16.6g,但实际小于16.6g,所以是碳酸氢钠过量,氢氧化钠的质量分数小于32%,故B正确.
=9.8%<14.5%,所以氢氧化钠过量,氢氧化钠的质量分数大于32%,第2份混合物的质量是第1份的2倍,如果两份氢氧化钠的质量分数相等,第2份反应后固体质量应为16.6g,但实际小于16.6g,所以是碳酸氢钠过量,氢氧化钠的质量分数小于32%,故B正确.C、根据表中数据能计算出第1份混合物中NaHCO3的质量分数,故C错误.
D、第2份混合物中减少的质量分数为:
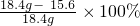 =15.2%>14.5%,所以氢氧化钠不足量,氢氧化钠的质量分数小于32%,故D正确;
=15.2%>14.5%,所以氢氧化钠不足量,氢氧化钠的质量分数小于32%,故D正确;故选BD.
点评:本题考查了钠的化合物的性质,难度较大,易错选项是A,因漏掉称量烧杯的次数而选A选项,注意碳酸氢钠和氢氧化钠的过量计算,从而选取正确选项.

练习册系列答案
相关题目
(2009?静安区一模)有2份质量分数不同的NaHCO3和NaOH的混合物,将它们分别用酒精灯加热至恒重测得的数据如下:
|
有2份质量分数不同的NaHCO3和NaOH的混合物,将它们分别用酒精灯隔绝空气加热至恒重并排除气体后恢复到常温,测得的数据如下:则下列叙述不正确的是
|
|
第一份 |
第二份 |
|
混合物的质量(g) |
9.2 |
20.8 |
|
反应后固体的质量(g) |
8.3 |
15.9 |
A.第二份得到的是纯净物
B.第一份混合物中NaOH的质量分数更大
C.根据表中数据不能计算出第一份混合物中NaHCO3的质量分数
D.第二份混合物中NaOH的物质的量小于NaHCO3的物质的量
有2份质量分数不同的NaHCO3和NaOH的混合物,将它们分别用酒精灯加热至恒重测得的数据如下:
经分析得到的15.6g固体是纯净物.则下列叙述正确的是( )
A.本次实验至少要进行6次称重
B.第1份混合物中NaOH的质量分数更大
C.根据表中数据不能计算出第1份混合物中NaHCO3的质量分数
D.第2份混合物中NaOH的质量分数小于32%
| 第1份 | 第2份 | |
| 混合物质量(g) | 9.2 | 18.4 |
| 反应后固体质量(g) | 8.3 | 15.6 |
A.本次实验至少要进行6次称重
B.第1份混合物中NaOH的质量分数更大
C.根据表中数据不能计算出第1份混合物中NaHCO3的质量分数
D.第2份混合物中NaOH的质量分数小于32%
有2份质量分数不同的NaHCO3和NaOH的混合物,将它们分别用酒精灯隔绝空气加热至恒重并排除气体后恢复到常温,测得的数据如下:则下列叙述不正确的是
| 第一份 | 第二份 | |
| 混合物的质量(g) | 9.2 | 20.8 |
| 反应后固体的质量(g) | 8.3 | 15.9 |
