题目内容
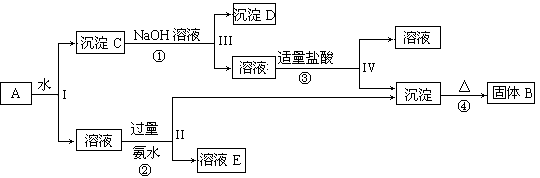
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 ,所用玻璃仪器有哪些
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式沉淀固体B ;沉淀D ;溶液E 。
(3)写出①、②、③、④四个反应方程式,离子反应写离子方程式。
① ;
② ;
③ ;
④ 。
【答案】(1)过滤,漏斗、玻璃棒、烧杯;
(2)Al2O3;Fe2O3;K2SO4、(NH4)2SO4;
(3)①Al2O3+2OH-=2AlO2-+H2O;②Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
③AlO2-+H++H2O=Al(OH)3↓;④2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。
【解析】
试题分析:(1)根据四步,得到沉淀和溶液,因此分离采取过滤的方法,用到仪器有带铁圈的铁架台、漏斗、烧杯、滤纸、玻璃棒,因此玻璃仪器有烧杯、玻璃棒、烧杯;
(2)KAl(SO4)2可溶于水,Fe2O3和Al2O3不溶于水,因此加水溶解,沉淀C为Al2O3、Fe2O3,溶液中是KAl(SO4)2,氧化铝表现两性,氧化铁不溶于氢氧化钠,则沉淀D为Fe2O3,Al2O3+2OH-=2AlO2-+H2O,溶液中溶质为NaAlO2,盐酸的酸性强于偏铝酸,因此有:AlO2-+H++H2O=Al(OH)3↓,氢氧化铝不稳定,受热易分解,2Al(OH)3![]() Al2O3+3H2O,反应②发生:Al3++3NH3·H2O=Al(OH)3↓+3NH4+,因此答案分别是Al2O3;Fe2O3;K2SO4、(NH4)2SO4;
Al2O3+3H2O,反应②发生:Al3++3NH3·H2O=Al(OH)3↓+3NH4+,因此答案分别是Al2O3;Fe2O3;K2SO4、(NH4)2SO4;
(3)根据上述分析,因此有:①Al2O3 + 2OH- = 2AlO2- + H2O;②Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+ ;③AlO2- + H+ + H2O = Al(OH)3↓ ;④2Al(OH)3 ![]() Al2O3 + 3H2O。
Al2O3 + 3H2O。

【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁(已知其中有一种中间产物是MgCO3)。

若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
表2原料价格表
物质 | 价格/元吨-1 |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。
(1)在步骤②中加入的试剂X,最佳的选择是______,其反应的离子方程式是 。
(2)在步骤③中如要控制pH=9.8,其目的是______;在步骤④中加入的试剂Y应是______;
(3)在步骤⑤中发生的化学方程式是______。