题目内容
实验室制乙烯,常因温度过高生成少量SO2,有人设计了如下图所示实验,以验证上述混合气体中是否含有乙烯和SO2。
(1) 装置中X仪器的名称是: ; 碎瓷片的作用是: 。
(2) 写出生成乙烯的反应方程式: 。
(3)A、B、C、D装置中盛放的试剂是(从下列所给试剂中选出,填序号)
①品红溶液,②NaOH溶液,③ KMnO4酸性溶液。
A. B. C. D.
(4)能说明SO2气体存在的现象是 。
(5)确证含有乙烯的现象是 。
(1)分液漏斗 (1分) 防暴沸 (2分)
(2)CH3CH2OH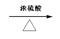 CH2=CH2 ↑+ H2O (2分)
CH2=CH2 ↑+ H2O (2分)
(3)①②①③ (2分)
(4)A中品红溶液褪色 (2分)
(5)C中品红溶液不褪色,D中高锰酸钾溶液紫色变浅或褪去。(2分)(只答出后半句给1分)
解析试题分析:(1)装置X的名称是分液漏斗,碎瓷片的作用是防止溶液暴沸;
(2) 实验室制乙烯的反应为 CH3CH2OH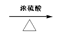 CH2=CH2 ↑+ H2O
CH2=CH2 ↑+ H2O
(3)乙烯和二氧化硫均可以使酸性高锰酸钾褪色,在检验乙烯前应把二氧化硫除去,所以A放①验证二氧化硫的存在,B放②除去二氧化硫,C放①检验二氧化硫是否除尽,D放③检验乙烯的存在;
(4)A中的品红溶液褪色说明存在二氧化硫气体;
(5)C中的品红不褪色,说明二氧化硫已除尽,D中的高锰酸钾褪色,说明存在乙烯气体。
考点:考查乙烯、二氧化硫的检验,乙烯的实验室制法

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。其装置如下图所示,试回答下列问题。
(1)图中①、②、③、④装置可盛放的试剂是
①________;②________;③________;④________。(将下列有关试剂的序号填入空格内)
| A.品红溶液 | B.NaOH溶液 |
| C.浓H2SO4 | D.酸性KMnO4溶液 |
(3)使用装置②的目的是________________________________。
使用装置③的目的是________________________________。
(4)能说明含有乙烯的现象是________________________________。
Ⅰ、德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状。为了评价凯库勒的观点,某学生设计了以下实验方案:①按下图所示的装置图连接好各仪器;②检验装置的气密性;③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开K1、K2、K3止水夹;④待烧瓶C中气体收集满后,将导管D的下端插入烧杯里的水中,关闭K2,打开K3,挤压预先装有水的胶头滴管的胶头,观察实验现象。
试回答:
(1)写出A中发生反应的化学方程式 ;能证明凯库勒观点错误的实验现象是 ;
(2)装置B的作用是 ;
Ⅱ、用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液。
(2)取10.00mL待测液,用 量取注入锥形瓶中。(填仪器)
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视 ,直到滴定终点。
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度: 。
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
下面是一种三肽,它可以看作是3个氨基酸缩合而得到的产物 。
。
现有一个多肽分子,分子式为CXHYN12OD(X,Y,D为自然数)将它完全水解后只得到下列三种氨基酸 ,现将一个该多肽分子水解后,得到天门冬氨酸的分子个数为( )
,现将一个该多肽分子水解后,得到天门冬氨酸的分子个数为( )
| A.D-12 | B.D-13 | C.(D-12)/2 | D.(D-13)/2 |
每年的6月26日是国际禁毒日,珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是( )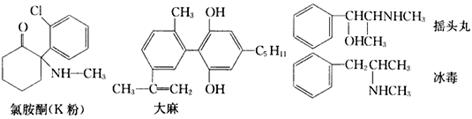
| A.四种毒品中都含有苯环,都属于芳香烃 |
| B.摇头丸经消去、加成反应可制取冰毒 |
| C.1mol大麻与溴水反应最多消耗4mol Br2 |
| D.氯胺酮分子中环上所有碳原子不可能共平面 |


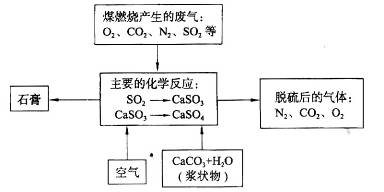

 (1)烧瓶中除反应物以外,还应放2-3块碎瓷片,目的是 。
(1)烧瓶中除反应物以外,还应放2-3块碎瓷片,目的是 。