题目内容
下图中所示的实验方法、装置或操作正确的是( )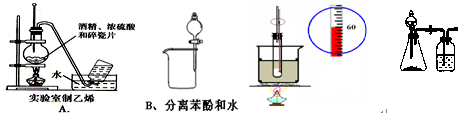
C.实验室制硝基苯 D.探究硫酸、苯酚、碳酸酸性强弱

C.实验室制硝基苯 D.探究硫酸、苯酚、碳酸酸性强弱
D
试题分析:A中温度计的水银球没有插入到溶液中,不正确;B中没有用铁架台固定分液漏斗,错误。C中温度计测量的应该是水浴的温度,不正确,因此答案选D。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
