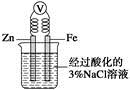
题目内容
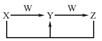
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
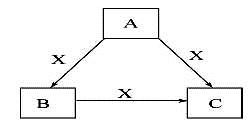
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素在元素周期表中的位置为__________,向水中加入X物质,X对水的电离平衡的影响是 (填“促进”、“抑制”或“无影响”) 。
②A与C的水溶液混合后生成B反应的离子方程式为 。
(2)若A为固态非金属单质,A与X同周期,同时A在X中燃烧,产生白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
①若A为该元素的白色固体单质,则1mol A单质中含共价键数目为 NA ,B的电子式为___________。
②X与水反应的离子方程式为 。
(3)若A、B、C的焰色反应呈黄色,水溶液均为碱性,常温下,X为气态酸性氧化物。
①A中所含有的化学键类型是_____________________。
②C溶液中离子浓度由小到大的顺序是__ _________________ 。

(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素在元素周期表中的位置为__________,向水中加入X物质,X对水的电离平衡的影响是 (填“促进”、“抑制”或“无影响”) 。
②A与C的水溶液混合后生成B反应的离子方程式为 。
(2)若A为固态非金属单质,A与X同周期,同时A在X中燃烧,产生白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
①若A为该元素的白色固体单质,则1mol A单质中含共价键数目为 NA ,B的电子式为___________。
②X与水反应的离子方程式为 。
(3)若A、B、C的焰色反应呈黄色,水溶液均为碱性,常温下,X为气态酸性氧化物。
①A中所含有的化学键类型是_____________________。
②C溶液中离子浓度由小到大的顺序是__ _________________ 。
(1)①第三周期ⅢA族 抑制
②3[Al(OH)4]-+ Al3+=4Al(OH)3↓
(2)①6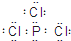
②Cl2+H2O= H++Cl-+ HClO
(3)①离子键、共价键
② C(CO32-)<C(H+)<C(OH-)<C(HCO3-)<C(Na+)
②3[Al(OH)4]-+ Al3+=4Al(OH)3↓
(2)①6
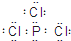
②Cl2+H2O= H++Cl-+ HClO
(3)①离子键、共价键
② C(CO32-)<C(H+)<C(OH-)<C(HCO3-)<C(Na+)
试题分析:(1)①若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有[Al(OH)4]?,x为氢氧化钠。所以A中含有的金属元素为Al,在元素周期表中的位置为:第三周期IIIA族;X为NaOH,强碱对抑制水的电离平衡。
②A中含Al3+、C中含[Al(OH)4]?,二者混合生成Al(OH)3,离子方程式为:3[Al(OH)4]-+ Al3+=4Al(OH)3↓
(2)①若A为固态非金属单质,A与X同周期,同时A在X中燃烧,产生白色烟雾,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。由转化关系可知,A为磷,B为三氯化磷,C为五氯化磷,x为氯气。若A为该元素的白色固体单质,则A为白磷,白磷分子为正四面体构型,所以1mol A单质中含共价键数目为6NA ,B为三氯化磷,电子式为:
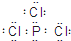
②X为氯气,与水反应的离子方程式为:Cl2+H2O= H++Cl-+ HClO
(3)若A、B、C的焰色反应呈黄色,水溶液均为碱性,常温下,X为气态酸性氧化物,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳。①A为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,为共价键,所以A中所含有的化学键是: 离子键、共价键。
②C为NaHCO3,HCO3?的水解程度大于电离程度,溶液呈碱性,所以NaHCO3溶液中离子浓度由小到大的顺序是:C(CO32-)<C(H+)<C(OH-)<C(HCO3-)<C(Na+)

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目