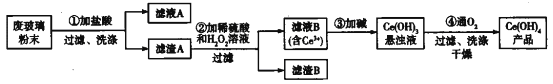
题目内容
【题目】用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1 g烧碱样品。
(2)将样品配成250 mL待测液,需要的仪器除了小烧杯、玻璃棒、量筒还需要____、____。
(3)取10.00 mL待测液,用____量取。
(4)用0.2010 mol·L-1标准盐酸滴定待测烧碱溶液,甲基橙作指示剂,滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视____,至出现_______的现象时即到达滴定终点。
(5)根据下列数据,计算待测烧碱的纯度:____。(保留两位有效数字)
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 0.10 | 22.10 |
第三次 | 10.00 | 4.00 | 24.10 |
(6)以下操作会造成测量结果偏高的是_______(填序号)。
①用蒸馏水冲洗锥形瓶
②在滴定过程中不慎将数滴酸液滴在锥形瓶外
③读数时,滴定前仰视,滴定后俯视
④装标准液之前,没有用标准液润洗滴定管
【答案】250 mL容量瓶(容量瓶规格不写不给分) 胶头滴管 碱式滴定管(或移液管) 锥形瓶中溶液颜色的变化 溶液由黄色变为橙色,且半分钟内不恢复 98% ②④
【解析】
(2)根据操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作选择仪器来解答;
(3)碱性溶液盛放在碱式滴定管中;
(4)滴定时,两眼注视锥形瓶中溶液颜色的变化,用0.2010molL-1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂溶液呈黄色,滴入盐酸反应终点变化为橙色;
(5)根据c(待测)=![]() 计算,V(标准)用第一次、第三次两次的平均值,第二次误差大舍去;
计算,V(标准)用第一次、第三次两次的平均值,第二次误差大舍去;
(6)根据c(待测)=![]() 分析误差,计算式中错误操作引起的变化全部变化为标准溶液体积的变化来判断浓度变化.
分析误差,计算式中错误操作引起的变化全部变化为标准溶液体积的变化来判断浓度变化.
(2)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器是:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,需要的仪器除了小烧杯、玻璃棒、量筒还需要250 mL容量瓶、胶头滴管,故答案为:250 mL容量瓶、胶头滴管;
(3)待测液是碱性溶液,取10.00mL待测液,用碱式滴定管量取,故答案为:碱式滴定管;
(4)滴定时,两眼注视锥形瓶中溶液颜色的变化,以便准确判断终点的到达;用0.2010molL-1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂溶液呈黄色,滴入盐酸反应终点变化为橙色且半分钟内不恢复,说明反应达到终点,故答案为:锥形瓶中溶液颜色的变化;溶液由黄色变为橙色,且半分钟内不恢复;
(5)图表中第一次消耗标准溶液体积=20.40ml-0.50ml=19.90ml,第二次消耗溶液体积=22.10mL-0.10mL=22.00mL,误差较大舍去,第三次消耗溶液体积=20.40mL-040mL=20.00mL,标准溶液平均消耗体积=![]() =19.95mL,待测液溶液浓度c=
=19.95mL,待测液溶液浓度c=![]() =0.4010mol/L,待测烧碱溶液的纯度=
=0.4010mol/L,待测烧碱溶液的纯度=![]() ×100%=98.05%,故答案为:98.05%;
×100%=98.05%,故答案为:98.05%;
(6)①用蒸馏水冲洗锥形瓶,对测定结果无影响,故①错误;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,消耗标准溶液体积增大,测定浓度偏大,故②正确;
③读数时,滴定前仰视,滴定后俯视,读取标准溶液体积减小,测定浓度偏小,故③错误;
④装标准液之前,没有用标准液润洗滴定管,消耗标准溶液体积增大,测定浓度偏大,故④正确;
故答案为:②④。