题目内容
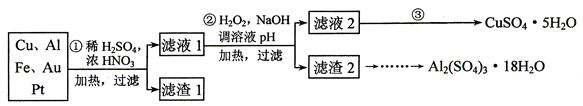
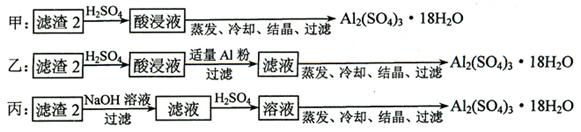
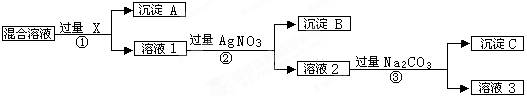
(9分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
请回答下列问题:
(1)写出下列物质的化学式:试剂X _______,沉淀A_______,沉淀B 。
(2)上述实验流程中加入过量的Na2CO3的目的是(用离子方程式表示) :
。
(3)按此实验方案得到的溶液3中肯定含有___________(填化学式,下同)杂质。为了除去该杂质,可以向溶液3中加入适量的___________ ,若要获得固体NaNO3需进行的实验操作是________________。

请回答下列问题:
(1)写出下列物质的化学式:试剂X _______,沉淀A_______,沉淀B 。
(2)上述实验流程中加入过量的Na2CO3的目的是(用离子方程式表示) :
。
(3)按此实验方案得到的溶液3中肯定含有___________(填化学式,下同)杂质。为了除去该杂质,可以向溶液3中加入适量的___________ ,若要获得固体NaNO3需进行的实验操作是________________。
(9分) (1)BaCl2[或Ba(NO3)2] BaSO4 AgCl (各1分)
(2)Ba2++ CO32-=BaCO3↓ 2Ag++ CO32-=Ag2CO3↓ (答两个3分,答一个1分)
(3)Na2CO3 HNO3 蒸发 (各1分)
(2)Ba2++ CO32-=BaCO3↓ 2Ag++ CO32-=Ag2CO3↓ (答两个3分,答一个1分)
(3)Na2CO3 HNO3 蒸发 (各1分)
考查物质的分离与提纯。
(1)由于操作②中加入的是硝酸银溶液,这说明X应该是钡盐,即X是氯化钡或硝酸钡,则沉淀A是硫酸钡。而沉淀B则是氯化银。
(2)由于溶液中钡离子和银离子都是过量的,所以碳酸钠的目的是除去过量的钡离子和银离子,反应放热离子方程式分别是Ba2++ CO32-=BaCO3↓、2Ag++ CO32-=Ag2CO3↓。
(3)由于加入的碳酸钠也是过量的,所以溶液3中一定含有碳酸钠。为除去碳酸钠,可以加入适量的硝酸。而要得到硝酸钠固体,需要的实验操作是蒸发。
(1)由于操作②中加入的是硝酸银溶液,这说明X应该是钡盐,即X是氯化钡或硝酸钡,则沉淀A是硫酸钡。而沉淀B则是氯化银。
(2)由于溶液中钡离子和银离子都是过量的,所以碳酸钠的目的是除去过量的钡离子和银离子,反应放热离子方程式分别是Ba2++ CO32-=BaCO3↓、2Ag++ CO32-=Ag2CO3↓。
(3)由于加入的碳酸钠也是过量的,所以溶液3中一定含有碳酸钠。为除去碳酸钠,可以加入适量的硝酸。而要得到硝酸钠固体,需要的实验操作是蒸发。

练习册系列答案
相关题目