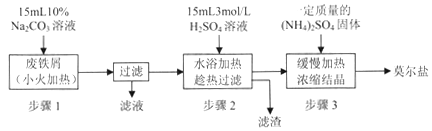
题目内容
【题目】已知在150℃时,NO2按下式发生分解反应2NO2![]() 2NO+O2 △H>0。向容积为1L的密闭容器中加入0.05molNO2在150℃时充分反应,达到平衡后测得c(NO)=0.04mol/L,吸收热量akJ。
2NO+O2 △H>0。向容积为1L的密闭容器中加入0.05molNO2在150℃时充分反应,达到平衡后测得c(NO)=0.04mol/L,吸收热量akJ。
(1)能说明上述反应已经达到化学平衡状态的是 。
A.容器内气体的颜色不再变化
B.容器内压强不再变化
C.容器内气体的密度不再变化
D.容器内气体的平均摩尔质量不再变化
E.v逆(NO2)=v正(NO)
F.相同时间内每消耗2个NO2分子的同时,生成2个NO分子
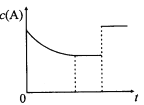
(2)下列有关该反应的图像中正确的是 。




(3)若从反应开始至c(NO)=0.04mol/L共耗时5分钟,则用O2表示的平均反应速率为 。
(4)150℃时上述反应的平衡常数数值为 (可不写单位)。
(5)若在相同的容器内开始时只加入0.05molNO和0.025molO2,在相同的温度下充分反应达到平衡后,恰好放出akJ的热量,则此时O2的转化率为 。
(6)恒容条件下,下列措施中能使n(NO2)/ n(NO)增大的有 。
A.降低温度 B.充入He气
C.再充入1 mol NO (g)和0.5 mol O2(g) D.使用催化剂
【答案】
(1)ABDE
(2)AD
(3)0.004mol/(L·min)
(4)0.32mol/L
(5)20%
(6)AC
【解析】
试题分析:
(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A.颜色深浅和NO2浓度有关系,当容器内气体的颜色不再变化,说明NO2浓度不变,反应达到化学平衡状态;B.反应2NO2![]() 2NO+O2为正反应方向气体系数增大的反应,当容器内压强不再变化,说明反应体系中各种物质的浓度不再发生变化,反应达到化学平衡状态;C.密度=质量÷体积,恒容密闭容器中,质量不变,体积也不变,则密度一直不变,所以当容器内气体的密度不再变化,不能说明反应达到化学平衡状态;D.混合气体的平均摩尔质量=混合气体的质量÷混合气体的总物质的量,质量不变,总物质的量变化,所以当容器内气体的平均摩尔质量不再变化时,说明反应达到化学平衡状态;E.v逆(NO2)=v正(NO),说明反应达到化学平衡状态;F.相同时间内每消耗2个NO2分子的同时,生成2个NO分子,都表示的是正反应速率,不能说明反应达到化学平衡状态;故选ABDE。
2NO+O2为正反应方向气体系数增大的反应,当容器内压强不再变化,说明反应体系中各种物质的浓度不再发生变化,反应达到化学平衡状态;C.密度=质量÷体积,恒容密闭容器中,质量不变,体积也不变,则密度一直不变,所以当容器内气体的密度不再变化,不能说明反应达到化学平衡状态;D.混合气体的平均摩尔质量=混合气体的质量÷混合气体的总物质的量,质量不变,总物质的量变化,所以当容器内气体的平均摩尔质量不再变化时,说明反应达到化学平衡状态;E.v逆(NO2)=v正(NO),说明反应达到化学平衡状态;F.相同时间内每消耗2个NO2分子的同时,生成2个NO分子,都表示的是正反应速率,不能说明反应达到化学平衡状态;故选ABDE。
(2)反应2NO2![]() 2NO+O2为正反应方向气体系数增大的吸热反应。A.升高温度,v逆、v正都增大,平衡正向移动,故A正确;B.升高温度,平衡正向移动,NO2转化率增大。压强增大,平衡逆向移动,NO2转化率减小,故B错误;C.升高温度,平衡正向移动,NO%增大。压强增大,平衡逆向移动,NO%减小,故C错误;D.根据先拐先平,可知T1>T2,升高温度,平衡正向移动,c(NO)增大,故D正确。故选AD。
2NO+O2为正反应方向气体系数增大的吸热反应。A.升高温度,v逆、v正都增大,平衡正向移动,故A正确;B.升高温度,平衡正向移动,NO2转化率增大。压强增大,平衡逆向移动,NO2转化率减小,故B错误;C.升高温度,平衡正向移动,NO%增大。压强增大,平衡逆向移动,NO%减小,故C错误;D.根据先拐先平,可知T1>T2,升高温度,平衡正向移动,c(NO)增大,故D正确。故选AD。
(3)反应开始至c(NO)=0.04mol/L共耗时5分钟,则v(NO)=0.04mol/L÷5min=0.008mol/(L·min),化学反应速率之比等于方程式的系数之比,则用O2表示的平均反应速率v(O2)为0.004mol/(L·min)。
(4)容积为1L的密闭容器中加入0.05molNO2在150℃时发生反应2NO2![]() 2NO+O2,达到平衡后测得c(NO)=0.04mol/L,则平衡时c(NO2)=0.01mol/L,c(O2)=0.02mol/L,则平衡常数K=
2NO+O2,达到平衡后测得c(NO)=0.04mol/L,则平衡时c(NO2)=0.01mol/L,c(O2)=0.02mol/L,则平衡常数K=![]() =
=![]() =0.32mol/L。
=0.32mol/L。
(5)在相同的容器内,相同的温度下加入“0.05molNO和0.025molO2”和加入“0.05molNO2”互为等效平衡,则平衡时O2的物质的量为0.02mol,此时O2的转化率为(0.025mol-0.02mol)÷0.025molO2×100%=20%。
(6)A.降低温度,平衡逆向移动,n(NO2)增大,n(NO)减小,则n(NO2)/n(NO)增大;B.充入He气,平衡不移动,则n(NO2)/n(NO)不变;C.再充入1 mol NO (g)和0.5 mol O2(g),相当于增大压强,平衡逆向移动,则n(NO2)/n(NO)增大;D.使用催化剂,平衡不移动,则n(NO2)/n(NO)不变;故选AC。

 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】从下列事实所列出的相应结论正确的是 ( )
实 验 事 实 | 结 论 | |
A | Cl2的水溶液可以导电 | Cl2是电解质 |
B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->HAlO2或Al(OH)3 |
D | SO2通入KMnO4溶液,溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D