题目内容
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(I) 将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s) + 3C(石墨) ![]() 2Fe(s) + 3CO(g) △H 1 =+489 kJ·mol-1
2Fe(s) + 3CO(g) △H 1 =+489 kJ·mol-1
C(石墨) +CO2 (g) ![]() 2CO(g) △H 2 = +172 kJ·mol-1
2CO(g) △H 2 = +172 kJ·mol-1
则Fe2O3(s) + 3CO(g) ![]() 2Fe (s) + 3CO2(g) △H=_________。
2Fe (s) + 3CO2(g) △H=_________。
②利用燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为电解质溶液),写出该电池的正极反式_________。
(II)如图所示,烧杯中都盛有稀硫酸。(1)中反应的离子方程式为______;比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是_____(用序号表示) 。
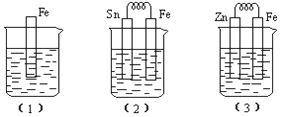
【答案】 -27KJ/mol O2 + 4H+ + 4e- =2H2O Fe + 2H+=Fe2+ +H2↑ ⑵>⑴>⑶
【解析】试题解析:(I)(1)①将两热化学方程式分别编号为a、b,依据盖斯定律a-b×3得到:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5KJ/mol,故答案为:△H=-28.5KJ/mol;②CO-O2酸性燃料电池放电时,正极上氧气被还原,电极反应式为:O2+4H++4e-=2H2O;(II)装置(1)中铁和稀硫酸反应置换反应,离子方程式为Fe+2H+==Fe2++H2↑;装置(2)是原电池,铁比锡活泼,做负极被腐蚀,比(1)中腐蚀速率快;装置(3)中锌比铁活泼,所以锌是负极,铁是正极,因此被腐蚀的是锌,故三个装置中纯铁被腐蚀的速率由快到慢的顺序是(2)>(1)>(3)。

练习册系列答案
相关题目