题目内容
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
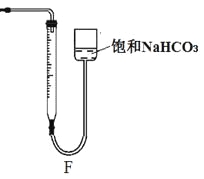
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置 II 中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2→Na2S2O5

(1)装置 I 中产生气体的化学方程式为_________________。
(2)装置 III 用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(3)证明NaHSO3溶液中 HSO3的电离程度大于水解程度,可采用的实验方法是___________(填序号)。
a.测定溶液的 pH
b.加入 Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是______________。
实验三 葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用 Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O→H2SO4+2HI)
①按上述方案实验,消耗标准 I2溶液 25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为____________g· L-1。
②在上述实验过程中,若有部分 HI 被空气氧化,则测得结果_____________(填“偏高”、 “偏低”或“不变”)。
【答案】(1)Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O
(2)d(1分);(3)a、e ;
(4)取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成
(5)①0.16 ②偏低(1分)
【解析】
试题分析:⑴装置I中浓硫酸与亚硫酸钠反应产生二氧化硫气体,同时生成硫酸钠和水,根据观察法将其配平。
⑵装置Ⅱ中析出Na2S2O5晶体,通过过滤操作得到该晶体。
⑶处理过量的SO2尾气,A项装置瓶口封闭,错误;B项食盐水不能将大量的SO2尾气吸收,错误;C项漏斗口没入了液体中,错误,D项氢氧化钠溶液可吸收SO2尾气,同时能防倒吸,正确。
⑷若NaHSO3溶液中HSO3- 的电离程度大于水解程度,则所得溶液显弱酸性,可通过测定溶液的pH(pH<7),用蓝色石蕊试纸检测(显红色)等途径来证明。
⑸若Na2S2O5晶体在空气中已被氧化,则应该生成Na2SO4,通过检验样品中是否含有SO42 -即可。
⑹①根据反应“SO2+I2+2H2O=H2SO4+2HI”,则样品中抗氧化剂的残留量=![]() =0.16 g/L。②若有部分HI被空气氧化又生成I2,导致消耗标准I2溶液的体积偏小,则测得结果偏低。
=0.16 g/L。②若有部分HI被空气氧化又生成I2,导致消耗标准I2溶液的体积偏小,则测得结果偏低。

 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案