题目内容
 用中和滴定法测定某盐酸的物质的量浓度.
用中和滴定法测定某盐酸的物质的量浓度.(1)标准溶液应盛于
(2)若选用酚酞作指示剂,以0.100 0mol?L-1的标准氢氧化钠溶液滴定,判断达到滴定终点的现象是
(3)实验数据记录如下表,请分析数据并计算,盐酸的物质的量浓度=
| 滴定次数 | 待测液体体积/mL | 标准碱液 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| ① | 20.0 | 0.40 | 20.41 |
| ② | 20.0 | 0.10 | 20.60 |
| ③ | 20.0 | 4.00 | 23.99 |
(2)根据待测液中加入酚酞,溶液为无色,反应完全后氢氧化钠过量,溶液变成红色判断达到终点现象;
(3)先判断滴定数据的有效性,然后根据有效的数据计算出盐酸的浓度.
故答案为:A;
(2)盐酸中加入酚酞,溶液显示无色,盐酸反应完全后,加入氢氧化钠溶液后,溶液显示红色,所以滴定终点为:滴入最后一滴氢氧化钠溶液,锥形瓶中溶液恰好出现红色且半分钟内红色不褪去,
故答案为:锥形瓶中溶液恰好出现红色且半分钟内红色不褪去;
(3)第一次滴定消耗标准液的体积为:20.41mL-0.40mL=20.01mL;
第二次滴定消耗标准液体积为:20.60mL-0.10mL=20.50mL,
第三次滴定消耗标准液体积为:23.99mL-4.00mL=19.99mL,
所以第二次滴定数据误差过大,应该舍弃,其它两次消耗的标准液的平均体积为:
| 20.01mL+19.99mL |
| 2 |
消耗的标准液氢氧化钠溶液的体积与盐酸溶液的体积相同,根据反应关系式:NaOH~HCl,所以待测液的浓度与标准液的浓度相同,都是0.100 0mol?L-1,
故答案为:0.100 0mol?L-1.

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
| |||||||||||
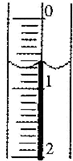 某化学兴趣小组使用酸碱中和滴定法测定市售白醋(主要成分为CH3COOH)的总酸量(g/100ml).
某化学兴趣小组使用酸碱中和滴定法测定市售白醋(主要成分为CH3COOH)的总酸量(g/100ml).