题目内容
以石墨电极电解200 mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V(g)(标准状况)的关系如下图所示。下列说法中,正确的是
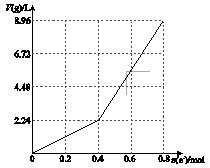
- A.电解前CuSO4溶液的物质的量浓度为2 mol/L
- B.电解后所得溶液中c(H+)=2 mol/L
- C.当n(e-)=0.6 mol时,V(H2)∶V(O2)=2∶3
- D.向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度
C
考查电解原理,重点是离子的放电顺序
从通过电子由0至0.4mol时间段内:
Cu2++2e-=Cu 4OH--4e-=2H2O+O2↑
0.2 0.4 0.4 0.1
从通过电子由0.4至0.6mol时间段内:
2H++2e-=H2↑ 4OH--4e-=2H2O+O2↑(相当于电解水)
0.2 0.2 0.1 0.2 0.05
A.电解前CuSO4溶液的物质的量浓度为:0.2/0.2=1 mol/L
B.通过电子由0至0.4mol时间段内电解了0.4molOH-,同时产生了0.4molH+,随后电解的是水,溶液的体积已经不在为200ml,故电解后所得溶液中c(H+)无法计算
C.由上述分析可得出:当n(e-)=0.6 mol时,V(H2)∶V(O2)=0.1:0.15=2∶3
D.电解过程除了有铜及氧气析出外,还电解了水,故单纯的向电解后的溶液中加入16 g CuO,并不能使溶液恢复为电解前的浓度
故答案为C
考查电解原理,重点是离子的放电顺序
从通过电子由0至0.4mol时间段内:
Cu2++2e-=Cu 4OH--4e-=2H2O+O2↑
0.2 0.4 0.4 0.1
从通过电子由0.4至0.6mol时间段内:
2H++2e-=H2↑ 4OH--4e-=2H2O+O2↑(相当于电解水)
0.2 0.2 0.1 0.2 0.05
A.电解前CuSO4溶液的物质的量浓度为:0.2/0.2=1 mol/L
B.通过电子由0至0.4mol时间段内电解了0.4molOH-,同时产生了0.4molH+,随后电解的是水,溶液的体积已经不在为200ml,故电解后所得溶液中c(H+)无法计算
C.由上述分析可得出:当n(e-)=0.6 mol时,V(H2)∶V(O2)=0.1:0.15=2∶3
D.电解过程除了有铜及氧气析出外,还电解了水,故单纯的向电解后的溶液中加入16 g CuO,并不能使溶液恢复为电解前的浓度
故答案为C

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目



