题目内容
自然界的矿物、岩石的成因和变化受到许多条件的影响.地壳内每加深1km,压强增大约25000~30000kPa.在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g)?SiF4(g)+2H2O(g)△H=-148.9kJ/mol.
(1)在地壳深处容易有
(2)如果上述反应在体积不变的密闭容器中发生,当达到平衡时,下列说法正确的是
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(3)若反应的容器容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为
(1)在地壳深处容易有
SiF4、H2O
SiF4、H2O
气体逸出,在地壳浅处容易有SiO2
SiO2
沉积.(2)如果上述反应在体积不变的密闭容器中发生,当达到平衡时,下列说法正确的是
c
c
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(3)若反应的容器容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为
0.0010mol/(L?min)
0.0010mol/(L?min)
.分析:(1)根据反应SiO2(s)+4HF(g)?Si4(g)+2H2O(g)进行分析;
(2)根据达到平衡状态,各组分浓度不变,正逆反应速率相等进行判断;
(3)根据质量差及反应方程式进行计算.
(2)根据达到平衡状态,各组分浓度不变,正逆反应速率相等进行判断;
(3)根据质量差及反应方程式进行计算.
解答:解:(1)SiO2(s)+4HF(g)?SiF4(g)+2H2O(g)+148.9kJ该反应为正反应体积减小的反应,增大压强,平衡向右移动,有SiF4(g)逸出,H2O(g)凝结为水,减小压强有SiO2(s)沉淀析出;故在地壳深处容易有SiF4、H2O 气体逸出,在地壳浅处容易有 SiO2沉积,
故答案为:SiF4、H2O;SiO2;
(2)建立平衡的标志有两个:正反应速率═逆反应速率、各物质的浓度保持不变;v正(HF)=2v逆(H2O)、v(H2O)正=2v(SiF4)逆、混合气体的密度保持不变,各组分的质量保持不变均达到平衡,所以c正确;
故选:c;
(3)由容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g/L,
则增加的质量为2.0L×0.12g/L=0.24g,由反应及元素守恒可知,每4molHF反应气体质量增加28+16×2=60g,
设参加反应的HF的物质量为x,
SiO2(s)+4HF(g)?SiF4(g)+2H2O(g)△m
4mol 1mol 2mol 60g
x 0.24g
=
,解得x=0.016mol,
v(HF)=
═0.0010mol/(L?min)
故答案为:0.0010mol/(L?min).
故答案为:SiF4、H2O;SiO2;
(2)建立平衡的标志有两个:正反应速率═逆反应速率、各物质的浓度保持不变;v正(HF)=2v逆(H2O)、v(H2O)正=2v(SiF4)逆、混合气体的密度保持不变,各组分的质量保持不变均达到平衡,所以c正确;
故选:c;
(3)由容积为2.0L,反应时间8.0min,容器内气体的密度增大了0.12g/L,
则增加的质量为2.0L×0.12g/L=0.24g,由反应及元素守恒可知,每4molHF反应气体质量增加28+16×2=60g,
设参加反应的HF的物质量为x,
SiO2(s)+4HF(g)?SiF4(g)+2H2O(g)△m
4mol 1mol 2mol 60g
x 0.24g
| 4mol |
| x |
| 60g |
| 0.24g |
v(HF)=
| 0.016mol | ||
|
故答案为:0.0010mol/(L?min).
点评:本题考查化学反应速率和化学平衡是化学基本理论的核心知识,特别是有关化学反应速率和化学平衡的计算及影响因素、化学平衡常数的表达式及其计算是高考的重点.

练习册系列答案
 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2 (s) + 4HF(g)  SiF4 (g) + 2H2O(g),若该反应在恒温恒容的密闭容器中发生,不能判断反应已经达到化学平衡的是( )
SiF4 (g) + 2H2O(g),若该反应在恒温恒容的密闭容器中发生,不能判断反应已经达到化学平衡的是( )
| A.v正(HF)= 2v逆(H2O) | B.混合气体的密度保持不变 |
| C.SiO2的质量保持不变 | D.反应物不再转化为生成物 |
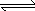 SiF4(g)+2H2O(g)+148.9 kJ
SiF4(g)+2H2O(g)+148.9 kJ SiF4
(g) + 2H2O(g),若该反应在恒温恒容的密闭容器中发生,不能判断反应已经达到化学平衡的是(
)
SiF4
(g) + 2H2O(g),若该反应在恒温恒容的密闭容器中发生,不能判断反应已经达到化学平衡的是(
)