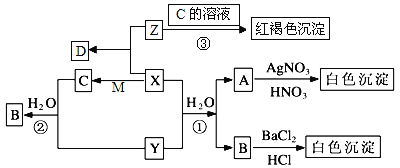
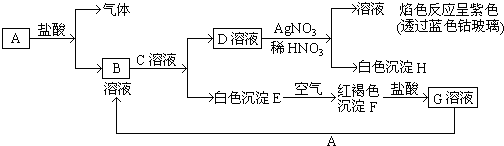
题目内容
【题目】常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1molL﹣1NaOH溶液.整个实验过程中溶液的pH变化曲线如右图所示,不考虑次氯酸分解,下列叙述正确的是( ) 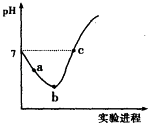
A.实验过程中用pH试纸测定溶液的pH
B.a~b段,溶液中 ![]() 减小
减小
C.b点对应溶液中:c(Cl﹣)>c(H+)>c(HClO)>c(ClO﹣)>c(OH﹣)
D.c点对应溶液中:c(Na+)=2c(ClO﹣)+c(HClO)
【答案】D
【解析】解:A.溶液中含有次氯酸,具有漂白性,不能用pH试纸测pH,应选pH计,故A错误; B.由a点到b点的过程是氯气的溶解平衡Cl2+H2OH++Cl﹣+HClO向右进行的过程,酸性逐渐增强,氢离子浓度逐渐增大,溶液中 ![]() 增大,故B错误;
增大,故B错误;
C.b点所示溶液中发生反应:Cl2+H2O=H++Cl﹣+HClO,HClO为弱电解质,部分电离,溶液中存在的粒子有:H+、Cl﹣、ClO﹣、OH﹣ , H2O、HClO、Cl2 , 溶液中:c(H+)>c(Cl﹣)>c(HClO)>c(ClO﹣)>c(OH﹣),故C错误;
D.c点溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒得c(H+)+c(Na+)=c(Cl﹣)+c(Cl0﹣)+c(OH﹣),所以c(Na+)=c(Cl﹣)+c(ClO﹣),根据物料守恒得c(Cl﹣)=c(ClO﹣)+c(HClO),所以c(Na+)=c(HClO)+2c(ClO﹣),故D正确;
故选D.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目