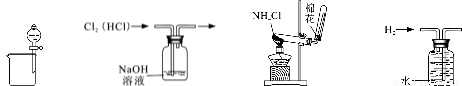
题目内容
某白色粉末由碳酸钠、硝酸镁、硫酸铜、氯化钾、氯化铵中的一种或几种组成。为了检验它们所含的物质,做了以下实验。①取部分粉末,加水溶解,得无色溶液。将所得溶液分成两份,分别进行实验;②在第一份溶液中滴加足量稀盐酸,有气泡产生,继续往反应后的溶液中滴加AgNO3溶液有白色沉淀生成;③在第二份溶液中滴加氢氧化钠溶液并加热,将湿润的红色石蕊试纸放在试管口,试纸变蓝。由此可判断固体混合物中肯定含 (写化学式,下同),肯定没有 ,可能含有 。对可能有的物质,可采用 来检验,如果含有该物质,其现象是 。步骤③中有关的化学方程式为: 。
Na2CO3 NH4Cl ,Mg(NO3)2 CuSO4 , KCl
【解析】
试题分析:因为溶液是无色的,肯定没有硫酸铜。加入盐酸产生气体,一定有碳酸钠。加入氢氧化钠产生氨气,一定有氯化铵。但没有白色沉淀则一定没有硝酸镁。无法确定氯化钾。
考点:利用物质的性质进行鉴定。

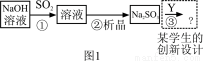
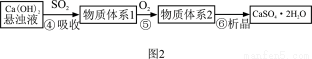
下图1是工业上“碱法烟气脱硫法” 示意图,下图2是工业上“石灰→石膏烟气脱硫法”示意图,回答:
已知:
试 剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
(1)图1中,反应①的离子方程式为 ,之一是 。
(2)图2中,反应⑤的目的是稳定固化硫元素形成高价态的化合物,氧气的作用是 。该法的优点之一是 。
(3)“碱法烟气脱硫法”中的产物Na2SO3的稳定性不好,易使硫元素重新转化为挥发性污染物,为避免之,设计了③的反应,写出其化学方程式为 。