题目内容
19.将2.8gCaO与500mL某浓度的盐酸充分反应,将所得溶液平分成两份,向一份溶液中加入足量Zn粒,产生0.560L(标准状况)气体.计算所用盐酸中HCl的物质的量浓度.分析 n(CaO)=$\frac{2.8g}{56g/mol}$=0.05mol,n(H2)=$\frac{0.560L}{22.4L/mol}$=0.025mol,根据H原子守恒得一份溶液中n(H+)=2n(H2)=2×0.025mol=0.05mol,则两份溶液中剩余n(H+)=2×0.05mol=0.1mol,根据CaO+2HCl=CaCl2+H2O知,与CaO反应消耗n(HCl)=2n(CaO)=2×0.05mol=0.1mol,根据c=$\frac{n}{V}$计算原来溶液浓度.
解答 解:n(CaO)=$\frac{2.8g}{56g/mol}$=0.05mol,n(H2)=$\frac{0.560L}{22.4L/mol}$=0.025mol,根据H原子守恒得一份溶液中n(H+)=2n(H2)=2×0.025mol=0.05mol,则两份溶液中剩余n(H+)=2×0.05mol=0.1mol,根据CaO+2HCl=CaCl2+H2O知,与CaO反应消耗n(HCl)=2n(CaO)=2×0.05mol=0.1mol,则原溶液中n(HCl)=(0.1+0.1)mol=0.2mol,则原溶液中c(HCl)=$\frac{0.2mol}{0.5L}$=0.4mol/L,
答:所用盐酸物质的量浓度是0.4mol/L.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,注意根据氢气计算的是一份溶液中氢离子物质的量,要计算原溶液中盐酸物质的量,应该将两份溶液中氢离子都计算,为易错题.

练习册系列答案
相关题目
9.已建立化学平衡的可逆反应,当改变条件使化学平衡向正方向移动时,下列有关叙述正确的是( )
①生成物体积分数一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增大
④反应物浓度一定降低 ⑤正反应速率一定大于逆反应速率.
①生成物体积分数一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增大
④反应物浓度一定降低 ⑤正反应速率一定大于逆反应速率.
| A. | ①② | B. | ③④ | C. | ②⑤ | D. | ③⑤ |
7.下列化合物中,既显酸性,又能发生酯化反应和消去反应的是( )
| A. |  | B. | 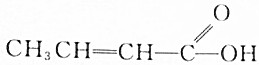 | ||
| C. | 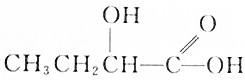 | D. | 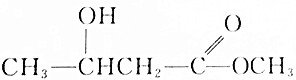 |
14.下列关于HX性质的叙述正确的是( )
| A. | HX极易液化,液态HX不导电 | |
| B. | HX都是极性分子,按HF→HI分子极性递增 | |
| C. | HX都具有强烈刺激性气味的有色气体 | |
| D. | HCl水溶液的酸性:HI>HCl |
3.某地区的湖水中可能含有K+、NH4+、Fe3+、Al3+、Mg2+、CO32-、S2O32-、SO42-中的若干种,某研究小组为确定其成分,设计并完成了如下的实验:

已知:Ag2SO4+4S2O32-═2[Ag(S2O3)2]3-+SO42-、Ag2CO3+4S2O32-═2[Ag(S2O3)2]3-+CO32-则下列说法中正确的是( )

已知:Ag2SO4+4S2O32-═2[Ag(S2O3)2]3-+SO42-、Ag2CO3+4S2O32-═2[Ag(S2O3)2]3-+CO32-则下列说法中正确的是( )
| A. | 试样溶液中肯定存在S2O32-、CO32-,可能含有NH4+、Al3+、K+ | |
| B. | 沉淀1的成分肯定为BaSO4和S的混合物 | |
| C. | 将少量气体1通入溶液2中肯定会产生白色沉淀 | |
| D. | 取少量溶液1滴加KSCN溶液,溶液显红色 |
10.下列废弃物处置方法不正确的是( )
| A. | 将除铁锈后残余的稀硫酸倒入废液缸中 | |
| B. | 将制备氧气后残余的二氧化锰回收利用 | |
| C. | 将还原氧化铜后残余的一氧化碳点燃 | |
| D. | 将用剩的白磷溶解于CS2后倒入垃圾箱 |
8.相同温度下,体积均为1.5L的两个恒容容器中发生可逆反应:X2(g)+3Y2(g)═2XY3(g)△H=-92.6kJ•mol-1,实验测得有关数据如下表:
下列叙述不正确的是( )
| 容器 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3 kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A. | 容器①中达到平衡时,Y2的转化率为50% | |
| B. | Q=27.78 kJ | |
| C. | 相同温度下;起始时向容器中充入1.0 X2 mol、3.0 mol Y2和2 mol XY3;反应达到平衡前v(正)>v(逆) | |
| D. | 容器①、②中反应的平衡常数相等,K=$\frac{16}{27}$ |
 (1)实验室里需用480ml 0.2mol/L的硫酸铜溶液,若以胆矾(化学式为CuSO4•5H2O)为原料进行配制,请回答下列问题:
(1)实验室里需用480ml 0.2mol/L的硫酸铜溶液,若以胆矾(化学式为CuSO4•5H2O)为原料进行配制,请回答下列问题: